
【题目】如图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色的气体,E为Fe单质,它们存在如下转化关系,反应中生成的水及次要产物均已略去.
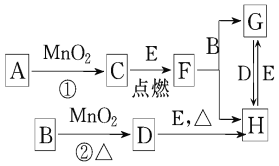
(1)写出有关物质的名称:B__________,F______________
(2)写出F与金属铝在高温下的反应化学方程式____________________________
(3)若反应①是在加热条件下进行的,则A是____________ (填化学式);
(4)指出MnO2在相关反应中的作用:反应②中是________剂.
(5)写出B与MnO2共热获得D的化学方程式: __________________________.
(6)实验室检验H中的阳离子的方法是______________________________
【答案】浓盐酸四氧化三铁8Al +3Fe3O4 ![]() 9Fe +4Al2O3KClO3氧化MnO2+4HCl(浓)
9Fe +4Al2O3KClO3氧化MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色
MnCl2+Cl2↑+2H2O加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色
【解析】
D为黄绿色气体,则D为Cl2,B与二氧化锰在加热条件下生成氯气,则B为浓盐酸,反应中二氧化锰起氧化剂作用,C为单质,则C为O2,若反应①是在加热条件下进行,则A是KClO3,若反应①是在常温条件下进行,则A为H2O2,E为Fe,F为Fe3O4,G为FeCl2,H为FeCl3,(1)由以上分析可知B为HCl,名称为浓盐酸;F为Fe3O4,名称为四氧化铁;(2)F为Fe3O4,与金属铝在高温下反应生成氧化铝和铁,反应的化学方程式为8Al +3Fe3O4 ![]() 9Fe +4Al2O3;(3)反应①是二氧化锰条件下制备氧气,若反应①是在加热条件下进行,则A是KClO3;(4)MnO2在反应②中二氧化锰为氧化剂;(5)B为浓盐酸,与MnO2共热制备氯气,同时生成氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)
9Fe +4Al2O3;(3)反应①是二氧化锰条件下制备氧气,若反应①是在加热条件下进行,则A是KClO3;(4)MnO2在反应②中二氧化锰为氧化剂;(5)B为浓盐酸,与MnO2共热制备氯气,同时生成氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O ;(6)H为氯化铁,实验室检验H中的阳离子铁离子的方法是加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色。
MnCl2+Cl2↑+2H2O ;(6)H为氯化铁,实验室检验H中的阳离子铁离子的方法是加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 min时H2O2的浓度c(H2O2)=0.314mol/L
B. 0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C. 6~10 min,过氧化氢的平均反应速率v(H2O2)=2.75×10-2mol/(L·min)
D. 反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、NH3、H2O、HF是第二周期的氢化物,也是生产生活中的重要物质。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为________________。
(2) NH3和H2O中稳定性较高的是:___________,NH3和PH3中沸点较高的是:__________。
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
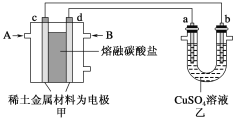
①装置中气体A为________(填“CH4”或“O2和CO2”),d极上的电极反应式为_______________________________________。
②乙装置中a极上的电极反应式为___________________。
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4________mL(标准状况),乙装置中所得溶液的pH=________(忽略电解前后溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )
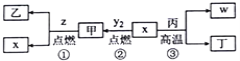
A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
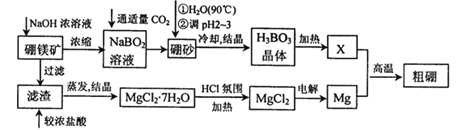
(1)硼砂中B元素的化合价为_______,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________。X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________。
(2)由MgCl2·7H2O制备MgCl2时,需要在HC1氛围中加热,其目的是________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·L-1。已知该温度下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。
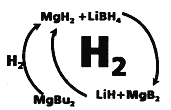
(4)写出放氢过程中发生反应的化学方程式:____________。
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×10-3,Kap(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。
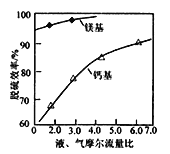
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
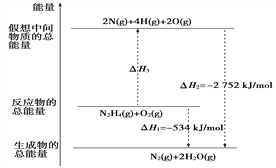
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:从石油中获得A是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
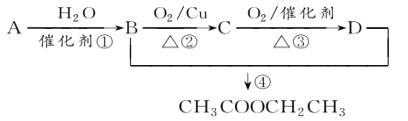
回答下列问题:
(1)写出A的结构简式______________。
(2)B、D分子中的官能团名称分别是__________________、________________。
(3)写出下列反应的反应类型:①________,②________,④________。
(4)写出下列反应的化学方程式:
①_______________________________;
④_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行电解。通电一段时间后,发现湿润的淀粉-KI试纸的C端变为蓝色。
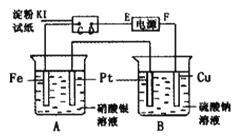
(1)E为电源的_________极F为电源的_________极
(2)A中发生反应的化学方程式为____________________________________。
(3)在B端观察到的现象是_____________________________________________。
(4)D端的电极反应式为_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com