
分析 液态有机物,它的蒸气密度为3.31g/L,M=3.31g/L×22.4L/mol≈74g/mol,3.7g该有机物完全燃烧后生成4.48LCO2(标准状况)和4.5g水,n(有机物)=$\frac{3.7g}{74g/mol}$=0.05mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,结合原子守恒推断有机物.
解答 解:液态有机物,它的蒸气密度为3.31g/L,M=3.31g/L×22.4L/mol≈74g/mol,3.7g该有机物完全燃烧后生成4.48LCO2(标准状况)和4.5g水,n(有机物)=$\frac{3.7g}{74g/mol}$=0.05mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,
(1)由原子守恒可知,含C原子为$\frac{0.2mol}{0.05mol}$=4,含H原子为$\frac{0.25mol×2}{0.05}$=10,含O原子为$\frac{74-4×12-10}{16}$=1,该有机物的分子式为C4H10O,
故答案为:C4H10O;
(2)该有机物能与钠反应放出H2,但不能发生催化氧化,含-OH,且与-OH相连C的邻位C上没有H,则结构简式为(CH3)3COH,故答案为:(CH3)3COH.
点评 本题考查有机物的推断,为高频考点,把握有机物燃烧规律、原子守恒推断有机物为解答的关键,侧重分析与应用能力的考查,注意醇的结构特点,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
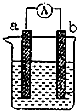 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
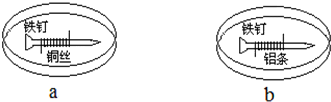
| A. | a中铁钉附近呈现红色 | B. | b中铁钉上发生还原反应 | ||
| C. | a中铜丝上发生还原反应 | D. | b铁钉上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化钠溶液中加入足量硝酸银溶液:Ag++Cl-=AgCl↓ | |
| D. | 氯化铁溶液中加入氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
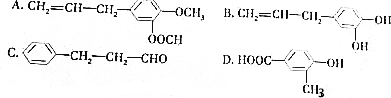
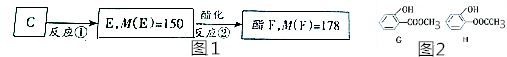
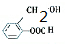 、
、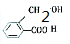 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不可能显碱性 | B. | 不可能显中性 | ||
| C. | 不可能显酸性 | D. | 可能中性、碱性、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000a%}{98x}$g/ml | B. | $\frac{x}{98a%}$g/mol | C. | $\frac{98x}{a%}$g/ml | D. | $\frac{98x}{10a}$g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
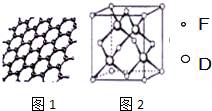 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
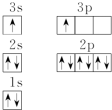
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com