
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和一定浓度的盐酸溶液。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号)。
(2)在配制NaOH溶液时:
填写下列表格:
应称取NaOH的质量/g | 应选用容量瓶的规格/mL |
__________________ | __________________ |
(3)容量瓶上需标有以下五项中的_________________(填序号)。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)下列配制的溶液浓度偏低的是________________________(填序号)。
A.配制前,容量瓶中有少量蒸馏水
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
(5)下图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/mL
HCl的质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为_________molL-1。
②取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是____________
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有_________影响?(在横线上填“偏大”、“偏小”、“无影响”)。
Ⅰ溶液注入容量瓶前没有冷却至室温________
Ⅱ 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水_________
【答案】AC 6.0 500mL容量瓶 ① ③ ⑤ BC 11.9 BD 偏高 偏低
【解析】
(1)所用仪器有:托盘天平、量筒、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙等,所以A、C不需要;
故答案是:AC;
(2)①要配制0.3mol·L-1 NaOH溶液480mL,应选择500mL容量瓶,需要氢氧化钠质量=0.3mol·L-1×0.5L×40g·mol-1=6.0g,配制480mL溶液,需要500mL容量瓶,
故答案为:6.0;500mL容量瓶;
(3)容量瓶上需标有以下五项中的①温度 ③容量 ⑤刻度线,故选:① ③ ⑤;
(4)A.配制前,容量瓶中有少量蒸馏水,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故A错误;
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.加蒸馏水时不慎超过了刻度线,说明实验失败,应该洗净容量瓶后重新配制,配制的溶液浓度偏低,故C正确;
D.用胶头滴管加水定容时俯视刻度,导致配制时加入的蒸馏水体积偏小,配制的溶液浓度偏高,故D错误;
故选BC。
(5)①该浓盐酸的物质的量浓度为:c=![]() mol·L-1=11.9mol·L-1,故答案为:11.9;
mol·L-1=11.9mol·L-1,故答案为:11.9;
②取用任意体积的该盐酸溶液时,溶液的物质的量浓度、溶液的密度为定值,与溶液的体积无关,而溶液中氯离子的物质的量、氯离子数目与溶液的体积有关,
故答案为:BD;
③在配制过程中,Ⅰ溶液注入容量瓶前没有冷却至室温,冷却后溶液体积变小,溶液浓度偏高;Ⅱ 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,配制的溶液浓度偏低。
故答案为:偏高;偏低。


科目:高中化学 来源: 题型:
【题目】过渡元素由于其特殊的核外电子排布而其有特殊的性质,成为化学研究的重点和前沿。
(l)过波元素处于周期表的____区和f 区。
(2)过渡元素能形成简单化合物,还能形成多种配位化合物
① 通常,d轨道全空或全满的过渡金属离子与水分子形成的配合物无颜色,否则有颜色。如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+____(填“有”或“无”)颜色。
② Ni2+可形成多种配合物,如Ni(CN)42-。写出CN-的电子式____,若其中两个CN-被NO2-替换,得到的配合物只有两种结构,则Ni(CN)42-的空间构型是_____, NO2-的空间构型是_____,其中N原子的杂化方式是_____。
③ 从结构角度分析并比较CoF2与CoCl2晶体的熔点高低___________。
(3)金、铜等金属及合金可用作生产石墨烯的催化剂,下图是一种铜金合金的晶胞示意图:

① 在该铜金合金的晶体中,与Cu原子距离相等且最近的Au原子数为_______。
② 原子坐标参数是用来表示晶胞内部各原子相对位置的指标,若A的原子坐标参数为(0,0,0);B的原子坐标参数为(0,1,0) , C的原子坐标参数为(l,0,0)。则D的原子子坐标参数为_________。
③ 若Au、Cu原子半径分别为r1和r2,则该晶胞中的原子空间利用率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为 136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
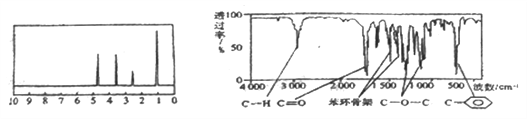
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中分子数相同的是( )
A.2L CO和2L CO2B.9gH2O和标准状况下 11.2LCO2
C.标准状况下1molO2和22.4LH2OD.0.2molH2和4.48LHCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=12的氢氧化钠溶液中含有OH- 数目为0.01 NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:
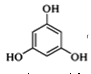 +2CH3OH
+2CH3OH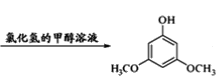 +2H2O
+2H2O
甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:

(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是__。
②萃取用到的分液漏斗使用前需__洗净,分液时有机层在分液漏斗的__填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是__。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属同一族,它们原子的最外层电子排布式为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是________。
(2)由这5种元素组成的一种化合物是(写化学式)______________________。写出该物质的一种主要用途:_________________________________________
(3)写出C元素基态原子的电子排布式:_______________________________。
(4)用电子排布图表示D元素原子的最外层电子排布:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,有关合成路线图如下:
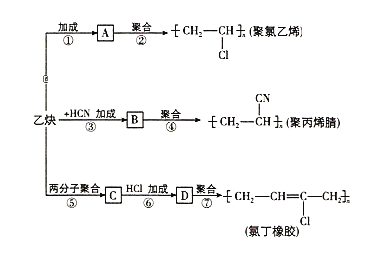
已知反应:nCH2=CH-CH=CH2![]()
![]()
请完成下列各题:
(1)写出物质的结构简式:A__________,C__________。
(2)写出反应的化学方程式:
反应① :____________________;
反应③ :____________________;
反应⑦ :____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com