
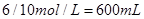
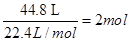 ,即
,即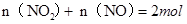 ①
①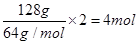 ,则
,则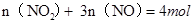 ②,由①②可解出
②,由①②可解出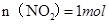 ,
,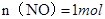 ,即
,即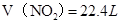 ,
,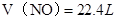 。
。

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②①③ | C.③②① | D.③①② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2用作呼吸面具的供氧剂 | B.实验室用浓盐酸和MnO2制备Cl2 |
| C.工业上利用硫酸吸收氨气制备氮肥 | D.自来水厂用C lO2杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法正确的是( )| A.KClO3在反应中得到电子 | B.ClO2是氧化产物 |
| C.H2C2O4在反应中被还原 | D.1 mol KClO3参加反应有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
| 主要 成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com