
(6分)溶液中C(Al3+)=1mol/L,C(NH4+)=2mol/L,若取该溶液100mL,当加入1mol/L NaOH溶液 mL时,沉淀量不再增加,当又加入 mL时,溶液恰好变为澄清。
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
向含有MgCl2、AlCl3两种溶质的混合溶液中逐滴滴加7mLNaOH溶液后再逐滴滴加盐酸至不再发生化学反应,所得沉淀的物质的量Y与所加试剂的体积V之间的关系如图所示,以下结论错误的是(不考虑Mg2+、Al3+的水解) ![]() 学科网
学科网

![]() 学科网
学科网
![]() 学科网
学科网
![]() 学科网
学科网
A.上述NaOH溶液和HCl溶液的物质的量浓度之比为2:1![]() 学科网
学科网
B.原混合溶液中c(Al3+):c(Mg2+):c(Cl一)=1:1:5![]() 学科网
学科网
C.当加入的HCl溶液的体积为4mL时,溶液中c(Na+):c(C1一)=1:2![]() 学科网
学科网
D.最终得到的溶液中c(A13+):c(Mg2+):c(Cl![]() )=1:1:14
)=1:1:14![]() 学科网
学科网
查看答案和解析>>
科目:高中化学 来源: 题型:
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省苏南四校高三12月月考试化学试卷(带解析) 题型:填空题
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏南四校高三12月月考试化学试卷(解析版) 题型:填空题
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
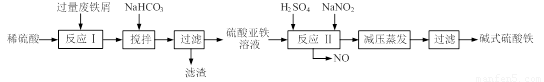
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省宁德市毕业班质量检查(理综)化学部分 题型:填空题
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
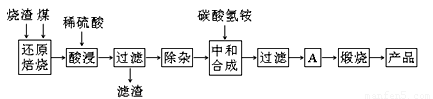
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
|
氢氧化物 |
Al(OH)3 |
Mg(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀的pH |
3.10 |
8.54 |
2.01 |
7.11 |
|
完全沉淀的pH |
4.77 |
11.04 |
3.68 |
9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com