
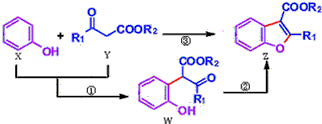
| A. | 反应①属于加成反应 | B. | W中含有三种不同的官能团 | ||
| C. | X、Y、W、Z都能与NaHCO3溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
分析 A.从官能团的转化判断反应类型;
B.W中含有羟基、酯基和羰基等官能团;
C.能与NaHCO3反应的官能团为羧基;
D.X、W含有酚羟基,可与溴水发生取代反应.
解答 解:A.从有机物的结构和官能团的转化可知反应①为取代反应,故A错误;
B.根据W的结构简式可知,W中含有酚羟基、羰基、酯基等,至少含有3种官能团,故B正确;
C.X含有酚羟基、Y含有酯基、W含有酚羟基和酯基、Z含有酯基,所以它们都不能与碳酸氢钠溶液反应,故C错误;
D.X、W都含有酚羟基,不能用溴水或FeCl3溶液鉴别,故D错误;
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,题目难度不大,注意把握有机物官能团的性质,为解答该题的关键,易错点为A,注意根据官能团的变化判断反应的类型.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
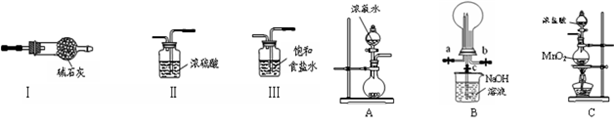
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
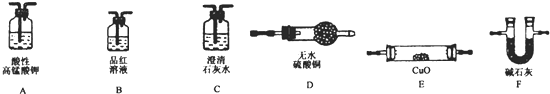
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、Na、S、Cl、N | B. | H、Na、S、Br、P | C. | H、Li、O、F、N | D. | H、Mg、S、O、N |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
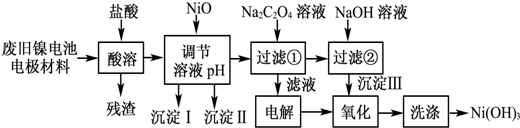
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 Na2SO3溶液加水稀释,c(H+):c(SO32-)的值逐渐减小 | |
| B. | pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol•L-1 | |
| C. | pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性 | |
| D. | 把0.2mol•L-1醋酸与0.1mol•L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①②③全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com