
����Ŀ����һ�������£���3mol A��1mol B�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g����B��g��![]() xC��g����2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D�������C��Ũ��Ϊ0.2mol��L��1�������жϴ������( )
xC��g����2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D�������C��Ũ��Ϊ0.2mol��L��1�������жϴ������( )
A��x��1
B��B��ת����Ϊ80%
C��2min��A��ƽ����Ӧ����Ϊ0.3 mol��(L��min)��1
D�������������ܶȲ��䣬Ҳ�������÷�Ӧ�ﵽƽ��״̬

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
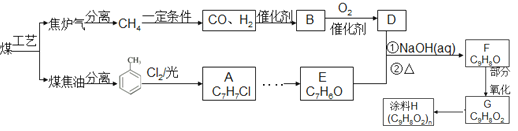
����Ŀ����úΪԭ�Ͽɺϳ�Ϳ��H(����ͼ)��B����ʽΪC2H6O�������Ʒ�Ӧ�ų���������ע��������ijЩ��Ӧ����û�и�������
��ش�
��1��������ú���ۺ����õĹ�������Ϊ ��
��2��B�Ľṹ��ʽ�� ��E�к��������ŵ������� ��
��3��G��H��Ӧ�Ļ�ѧ����ʽ ��
��4�����ڻ�����F,����˵����ȷ���� ��
A���ܷ���������Ӧ B����ʹBr2��CCl4��Һ��ɫ
C���ܷ���ˮ�ⷴӦ D����������Ʒ�Ӧ
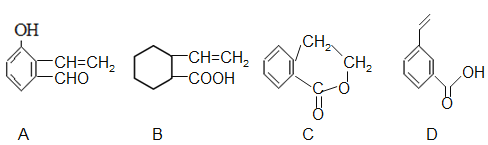
��5�������л�����G���ǻ�Ϊͬ���칹����� ��
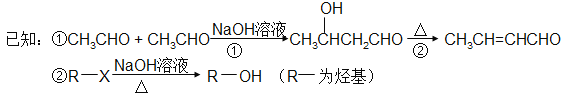
��6���� ��E �ĺϳ�·�ߣ��Լ����ܼ���ѡ���ϳ�·�߲��ա���֪�١�����д��ʽ�� ��
��E �ĺϳ�·�ߣ��Լ����ܼ���ѡ���ϳ�·�߲��ա���֪�١�����д��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�ˮ�����ӳ���KW��10��13�������¶���pH��11��Ba(OH)2��ҺaL��pH��1��H2SO4��ҺbL��ϣ�������Һ���Ϊ����֮�ͣ����ù���������Բ��ơ�
��1�������û����ҺΪ���ԣ���a:b��________�����ɳ������ʵ���Ϊ______mol(�ú�b����ʽ����ʾ)��
��2����a:b��9:2����������ҺpH��_____���û����Һ������ܽ�����_______g(�ú�a��b����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪������2NO+Na2O2=2NaNO2 ��2NO2+Na2O2=2NaNO3������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4����ԭ��Mn2+��
��Ʒ�Ʊ�����飺����ͼ1װ���Ʊ�NaNO2��
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ__________
��2��Bװ�õ�������_______
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ����������ơ�̼���ơ��������ƣ�Ϊ�Ʊ�����NaNO2Ӧ��B��Cװ�ü�����һ��װ�ã������ҿ��ڻ������ӵ�װ��ͼ2��������ʢ�ŵ��Լ���
��4�������ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_____________________
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
![]()
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������________��˫��ѡ��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ��������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������________���������4λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�Ļ���ԭ�ϣ���ϳɵĽ���鰷����һ�ֿ�����ҩ����������ɭ֢�����õ���Ч���ɻ����ϩ�ϳɽ�����·�����£�
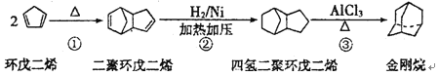
��ش��������⣺
��1�������ķ���ʽΪ_______________________��
��2����Ӧ�ٵķ�Ӧ������______________________��
��3���������������ۻ����ϩ�Ĺ�ϵ��_____________������ĸ����
a����Ϊͬϵ�� b����Ϊͬ���칹�� c����Ϊ���� d����Ϊ����
��4���������Ի�����Ϊԭ���Ʊ������ϩ�ĺϳ�·�ߣ�
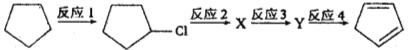
���� X��������______________��
��5����Ӧ4�Ļ�ѧ����ʽ��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п�̳�����Ҫ�ɷ�ΪZnO��������CuO��FeO��Ϊԭ�ϣ�������ȡ�Ȼ�п�ͽ���п��
����ȡ�Ȼ�п��Ҫ�������£�
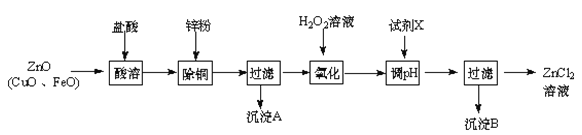
��֪��Zn���������������Al����������������ƣ�pH��11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2-���±��г�����ؽ������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0 mol��L��1����)��

��1������H2O2��Һ������Ӧ�����ӷ���ʽΪ ��
��2������ͼ�У�Ϊ�˽�����Һ����ȣ��Լ�X������ ��ѡ����ţ�a��ZnO��b��Zn(OH)2 ��c��Zn2(OH)2CO3 ��d��ZnSO4����pHӦ������ ��
��3���Ȼ�п�ܴ����ᣨ![]() �����ɱ�������C6H8O4���;����ᣬ�������Ľṹ��ʽΪ ��������Ľṹ��ʽΪ ��
�����ɱ�������C6H8O4���;����ᣬ�������Ľṹ��ʽΪ ��������Ľṹ��ʽΪ ��
����ȡ����п���ü��ܽ�{ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)}��Ȼ�����ȡҺ��
��4����ʯī���缫���ʱ����������������Ϊ �������ĵ缫��ӦΪ ��
��5����п�̳����ü��ܣ������������ܺ��⣬��Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�뼼�����ۺ��Ȼ�������Ļ�ѧʽΪ[Al2(OH)nCl6-n��xH2O]m������һ�ָ�Ч��ˮ�������������Ʊ�ԭ���ǵ�������AlCl3��Һ��pH��ͨ���ٽ���ˮ����ᾧ���������Ʊ�ԭ����Ҫ�����ӹ���ҵ�ķ����������ң�����Ҫ��Al2O3��Al������SiO2�����ʡ��ۺ��Ȼ��������Ĺ����������£�

��1��������Ȳ��������з�����Ӧ�����ӷ���ʽ ��
��2�����������в���B��D�����ƾ�Ϊ ��B��DΪ��������
��3����Ӧ�и���Ʒa�� ���û�ѧʽ��ʾ����
��4�����������п�ѭ��ʹ�õ������� ���û�ѧʽ��ʾ����
��5������pH��4.0~4.5��Ŀ���� ��
��6��ʵ����Ҫ�ⶨˮ��������Ʒ��n��x��ֵ��Ϊʹ�ⶨ�����ȷ����õ��ľ���ϴ���������������C���ʿ�ѡ�� ��
A��NaOH | B��Al | C����ˮ | D��Al2O3E��NaAlO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��7H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֡���������������м��������������������������Ϊԭ�����������̷���һ�ַ�����
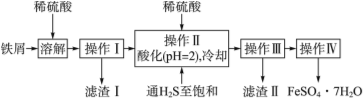
��ѯ���ϣ����й����ʵ�������������
25 ��ʱ | pH[] |
����H2S��Һ | 3.9 |
SnS������ȫ | 1.6 |
FeS��ʼ���� | 3.0 |
FeS������ȫ | 5.5 |
��1���������У�ͨ�����������͵�Ŀ����_______������Һ���������ữ��pH��2��Ŀ����________��
��2�����������Ҫ�ɷ���__________��
��3���������õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ�
�ٳ�ȥ������渽�ŵ���������ʣ���_____________________________��
��4���ⶨ�̷���Ʒ��Fe2�������ķ����ǣ�a����ȡ2.850 g�̷���Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�b����ȡ25.00 mL������Һ����ƿ�У�c���������ữ��0.010 00 mol��L��1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00 mL��
�ٵζ�ʱʢ��KMnO4��Һ������Ϊ__________����������������
���жϴ˵ζ�ʵ��ﵽ�յ�ķ�����____________________________��
�ۼ���������Ʒ��FeSO4��7H2O����������Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
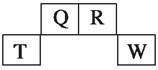
��1��TԪ�ص����ӽṹʾ��ͼΪ__________��
��2��Ԫ�صķǽ�����(ԭ�ӵõ��ӵ�����)��Q ________W(����ǿ��������������)��
��3��W�ĵ�����������������ˮ����Ũ��Һ�����ܷ�����Ӧ�������������ʣ�����һ�������壬�÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________________
��4��ԭ��������R��1��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��_________________________________________________________�䷴Ӧ��ĵ���ʽΪ �����Ӱ뾶T3+__________R3-����������������������������
��5��R�ж�����������м���Է���������С����һ�������£�2 L�ļ�������0.5 L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵ�R�ĺ�������ֻ��һ�֣���ú������εĻ�ѧʽ��____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com