
 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理基污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理基污染是环境化学当前的重要研究内容之一.分析 (1)①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa,二氧化硫转化率为0.8,则转化的二氧化硫为2mol×0.8=1.6mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):1.6 0.8 1.6
平衡量(mol):0.4 0.2 1.6
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;
②平衡常数只受温度影响,温度不变,平衡常数不变;
(2)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律,(①+②)÷2可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,进而计算放出的热量.
解答 解:(1)①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa,二氧化硫转化率为0.8,则转化的二氧化硫为2mol×0.8=1.6mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):1.6 0.8 1.6
平衡量(mol):0.4 0.2 1.6
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.02}$=800,
故答案为:800;
②平衡状态由A变到B时,压强增大,温度不变,平衡常数不变,平衡常数K(A)=K(B),
故答案为:=;
(2)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律,(①+②)÷2可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,4.48L甲烷物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,故放出的热量为0.2mol×867kJ•mol-1=173.4kJ,
故答案为:173.4kJ.
点评 本题考查化学平衡计算、运用盖斯定律计算反应热,难度不大,注意平衡常数及其单位与化学计量数有关.


科目:高中化学 来源: 题型:选择题
| A. | 某离子第三层上和第二层上的电子数均为第一层的4倍 | |
| B. | Cl-的结构示意图: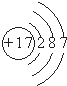 | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C和14N的质量数相等,互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.20 | 1.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
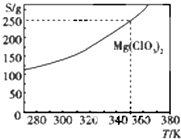 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ | |
| D. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃保存在带磨口玻璃塞的试剂瓶中 | |
| B. | 少量金属钠可保存在煤油中,大量的金属钠可保存在液体石蜡中 | |
| C. | 氢氟酸保存在磨口试剂瓶中 | |
| D. | 液溴密封盛放在无色试剂瓶中,并在液面上放一层水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(Cl-)+c(OH-) | |
| B. | 由水电离出的c(H+)=1.0×10ˉ 2 mol•Lˉ1 | |
| C. | 与等体积PH=12的氨水混合后所得溶液显中性 | |
| D. | 与等体积0.01 mol•Lˉ1CH3COONa溶液混合后所得溶液中:c(Cl-)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol/L | B. | 7.5 mol/L | C. | 10 mol/L | D. | 2.5 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com