
分析 (1)①B同在ⅠA族,当B在A的上一周期时,B和A的原子序数之差恰好为B所在周期的元素种类数,B在A的下一周期时,A和B的原子序数之差恰好为A所在周期的元素种类数;
②A、B同在ⅦA族时,A、B原子序数之差恰好为相邻两周期下一周期的元素种类数,与A、B同在ⅠA族相反;
(2)元素周期表中,从第四周期开始出现过渡元素,第ⅠA、ⅡA之后是第ⅢB,在第六、七周期中的过渡元素又出现镧系和锕系,根据周期表的结构来回答.
解答 解:(1)①A、B同在ⅠA族,当B在A的上一周期时,B和A的原子序数之差恰好为B所在周期的元素种类数,则B的原子序数为x-n;当B在A的下一周期时,A和B的原子序数之差恰好为A所在周期的元素种类数,则B的原子序数为x+m,故答案为:x-n;x+m;
②A、B同在ⅦA族时,A、B原子序数之差恰好为相邻两周期下一周期的元素种类数,与A、B同在ⅠA族相反,如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为x-m,当B在A的下一周期时,B的原子序数为 x+n.
故答案为:x-m;x+n;
(2)因为是同一周期的IIA族,即同一横行往右一个主族,在第二、三周期原子序数增加一,因而可以x+1;又因为IIA族与IIIA族元素在第四周期起有过渡元素,因而又可以x+11;在第六、七周期的过渡元素中又出现镧系和锕系,因而又可以x+25,故答案为:x+1或x+11或x+25.
点评 本题考查位置、结构、性质,熟悉原子结构、核电荷数、原子序数、核外电子数的关系即可解答,明确核外电子排布相同是解答本题的关键,难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
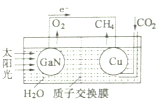 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是正极 | |
| C. | 铜电极表面的电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 过渡元素是副族和第Ⅷ族元素的总称 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti属于同种元素 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的质量数相同 | |
| C. | ${\;}_{22}^{48}$Ti的相对原子质量约为48 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为不同的核素,互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
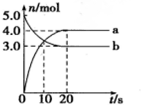
| A. | 曲线a表示NO2的物质的量随时间的变化 | |
| B. | 10s时,v(正)>v(逆) | |
| C. | 20s时反应达到平衡 | |
| D. | 0~20s内平均反应速率v(O2)=0.05mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 性质 | 金刚石 | 石墨 |
| 外观 | 无色,透明固体 | 灰黑,不透明固体 |
| 沸点 | ? | ? |
| 熔点 | ? | ? |
| 燃烧热/kJ•mol-1 | 395.4 | 393.5 |
| A. | C(石墨,s)═C(金刚石,s)△H=+1.9kJ•mol-1 | |
| B. | 在相同条件下石墨的熔点应高于金刚石 | |
| C. | 金刚石中碳碳键键能大于石墨中碳碳键键能 | |
| D. | 在相同条件下石墨和金刚石的沸点应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com