
解析:近年来的化学竞赛比较注重化学实验及有效数字的计算。这类题型,常常过程繁杂,解题技巧在于理清脉络,找出反应流程。本题反应流程如下: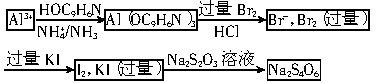
(1)Na2S2O3与I2反应的化学方程式为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)由反应: +5Br-+6H+=3Br2+3H2O,
+5Br-+6H+=3Br2+3H2O,
知Br2的总物质的量为3×0.1238×15.00×10-3mol,由Na2S2O3的物质的量为
0.1028×5.45×10-3mol,知所消耗的I2的物质的量为0.1028×5.45×10-3÷2mol,则过量的Br2的物质的量为0.1028×5.45×10-3÷2mol,因此,与HOC9H6N反应的Br2的物质的量为(3×0.1238×15.00×10-3-0.1028×5.45×10-3÷2)mol,根据反应的化学方程式得关系式:Al3+~3HOC9H6N~6Br2,故Al的含量为(3×0.1238×15.00×10-3-0.1028×5.45×10-3÷2)mol÷6×26.98g/mol=23.79mg。


科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Cu2+、AI3+ | ||||||
| 阴离子 | SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省宜春市高三4月模拟考试理综化学试卷(解析版) 题型:计算题
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
|
阴离子 |
SO42-、NO3-、Cl- |
|
阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
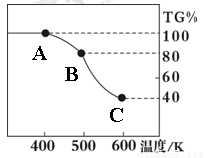
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(4分)在仅含有Al3+一种金属离子的某样品水溶液中,加入NH3-NH4Ac缓冲溶液,使pH=9.0,然后加入稍过量的8-羟基喹啉,使Al3+定量地生成喹啉铝沉淀:
Al3++3HOC9H6N![]() Al(OC9H6N)3↓+3H+
Al(OC9H6N)3↓+3H+
过滤并洗去过量的8-羟基喹啉,然后将沉淀溶于2mol?L-1HCl溶液中,即得8-羟基喹啉的酸溶液,用15.00mL 0.1238mol?L-1KBrO3-KBr标准溶液(即KBrO3的浓度为0.1238mol?L-1,KBr过量)处理,产生的Br2与8-羟基喹啉发生取代反应为:
HOC9H6N+2Br2![]() HOC9H4NBr2+2H++2Br-
HOC9H4NBr2+2H++2Br-
待取代反应完全以后,再加入过量的KI,使其与剩余的Br2反应生成I2,最后用0.1028mol?L-1 Na2S2O3标准溶液滴定析出的I2,终点时用去Na2S2O3标准溶液5.45mL。
(1) 写出Na2S2O3与I2反应的化学方程式:
。
(2) 由以上实验数据可算得样品中Al的含量为 mg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com