
| A. | 由反应①②可计算出CH3OH的燃烧热 | |
| B. |  反应②中的能量变化如图所示 | |
| C. | 可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ•mol-1 | |
| D. | 可推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
分析 A、根据燃烧热的概念结合盖斯定律将,②×3-①×2计算判断;
B、根据反应:CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1结合图象来判断;
C、已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H2=-192.9kJ•mol-1
根据盖斯定律,反应2H2(g)+O2(g)=2H2O(g)是2×②-2×①得到,据此计算;
D、甲醇的液态转化为气态过程需要吸收热量,据此回答.
解答 解:A、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故A正确;
B、根据反应:CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1,1mol甲醇消耗0.5mol氧气生成1mol二氧化碳和2mol氢气放出的热量为192.9kJ,故B错误;
C、已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H2=-192.9kJ•mol-1
根据盖斯定律,反应2H2(g)+O2(g)=2H2O(g)是2×②-2×①得到,所以反应的△H=2×192.9kJ•mol-1-2×49.0kJ•mol-1=-483.8kJ•mol-1,故C正确;
D、根据CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1,甲醇的液态转化为气态过程需要吸收热量,推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H>-192.9 kJ•mol-1,故D错误.
故选AC.
点评 本题考查了化学反应能量变化的分析判断,燃烧热概念理解计算,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可作食品的包装材料 | |
| C. | 碳酸氢钠可于治疗胃酸过多症 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
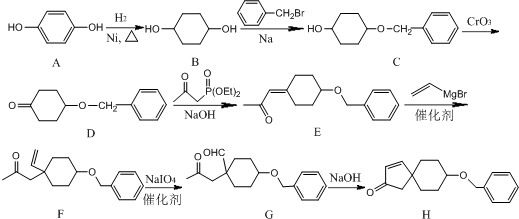
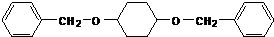 ;由C→D的反应类型是氧化反应.
;由C→D的反应类型是氧化反应.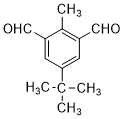 或
或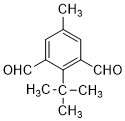 .
. 为有机原料制备
为有机原料制备 的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
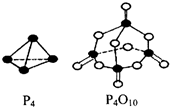 磷在氧气和氯气中都可以燃烧.
磷在氧气和氯气中都可以燃烧.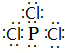 ;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com