
| A. | 铝粉与烧碱溶液反应:Al+6OH+═[Al(OH)4]-+H2↑ | |
| B. | 水玻璃中加入稀盐酸:Na2SiO4+2H+═H2SiO3↓+2Na+ | |
| C. | 二氧化硅与苛性钠溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入到水中:Cl2+H2O═2HCl-+ClO- |
分析 A.从电荷是否守恒的角度来判断;
B.物质的拆分错误,能拆的物质有强酸、强碱和可溶性盐;
C.二氧化硅是酸性氧化物,能与碱反应生成盐和水;
D.次氯酸为弱酸,离子方程式中次氯酸不能拆开.
解答 解:A.此离子方程式电荷不守恒,铝粉与烧碱溶液反应的离子方程式中,NaOH和NaAlO2可以拆,正确的离子方程式为:6H2O+2Al+2OH-═2[Al(OH)4]-+3H2↑,故A错误;
B.水玻璃中加入稀盐酸化学方程式:Na2SiO3+2HCl═H2SiO3↓+2NaCl,其中Na2SiO3和NaCl均为可溶性盐,可以拆,正确的离子方程式为:SiO32-+2H+═H2SiO3↓,故B错误;
C.二氧化硅是酸性氧化物,能与碱反应生成盐和水,化学方程式:SiO2+2NaOH═Na2SiO3+H2O,能拆的物质有强酸、强碱和可溶性盐,即NaOH和Na2SiO3能拆,故离子方程式为:SiO2+2OH-═SiO32-+H2O,故C正确;
D.氯气通入到水中,反应生成氯化氢和次氯酸,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).


科目:高中化学 来源: 题型:解答题

 ;
;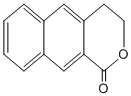 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,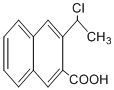 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: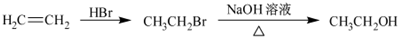
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质、油脂都是天然高分子化合物 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白质发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径和简单离子半径减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 14号元素的高纯单质可制光电池 | |
| D. | 单质的熔点降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$ +CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O
+CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O 、
、 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
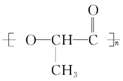 在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸是一种羧酸 | |
| C. | 聚乳酸的单体 | |
| D. | 其聚合方式与聚苯乙烯的聚合方式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前研究菠菜蛋白质“发电”不属于“太阳能文明” | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 石油和天然气都属于碳素燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com