
| 周期 期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ;⑪
;⑪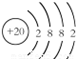 .
. ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min). 分析 (1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br;
(2)⑤为Al,原子核外有13个电子,有3个电子层,各层电子数为2、8、3;
⑪为Ca,原子核外有20个电子,有4个电子层,各层电子数为2、8、8、2;
(3)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体化学性质最不活泼;
(4)同周期自左而右金属性减弱,可以根据单质与氢气反应难易和剧烈程度、氢化物稳定性、最高价含氧酸的酸性、化合物中元素化合价等进行判断;
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)形成的化合物为NaCl;
(6)元素⑥的氧化物是现代光学及光纤制品的基本原料,该氧化物为二氧化硅,属于共价化合物;
(7)元素①的氢化物常用作制冷剂,该氢化物为NH3;
根据v=$\frac{△c}{△t}$计算v(NH3),再利用速率之比等于化学计量数之比计算v(N2).
解答 解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br,
故答案为:Mg;Br;
(2)⑤为Al,原子核外有13个电子,有3个电子层,各层电子数为2、8、3,原子结构示意图为 ;
;
⑪为Ca,原子核外有20个电子,有4个电子层,各层电子数为2、8、8、2,原子结构示意图为: ,
,
故答案为: ;
; ;
;
(3)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强,F的非金属性最强,稀有气体Ar最外层为稳定结构,化学性质最不活泼;
故答案为:K;F;Ar;
(4)同周期自左而右金属性减弱,故非金属性Cl>S,
a.单质的状态属于物理性质,不能比较非金属性强弱,故a错误;
b.非金属性越强,氢化物越稳定,⑧的氢化物比⑦的氢化物稳定,说明⑧的非金属性强,故b正确;
c.⑦和⑧的单质都能与氢氧化钠溶液反应不能比较非金属性强弱,故c错误,
故答案为:Cl;b;
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)形成的化合物为NaCl,属于离子化合物,
故答案为:离子;
(6)元素⑥的氧化物是现代光学及光纤制品的基本原料,该氧化物为SiO2,含有共价键,
故答案为:SiO2;共价;
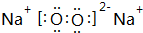
(7)元素①的氢化物常用作制冷剂,该氢化物为NH3,电子式为 ,
,
v(NH3)=$\frac{\frac{1.4mol}{4L}}{0.5min}$=0.7mol/(L.min),速率之比等于化学计量数之比,则v(N2)=$\frac{1}{2}$v(NH3)=0.35mol/(L.min),
故答案为: ;0.35mol/(L.min).
;0.35mol/(L.min).
点评 本题考查元素周期表与元素周期律综合运用,侧重对元素周期律与化学用语的考查,熟练掌握前四周期元素,掌握金属性、非金属性强弱比较实验事实.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
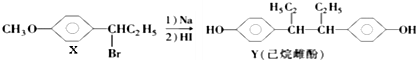
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与Br2发生加成反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-1nm) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ | |
| B. | ③④处于同一周期 | |
| C. | 元素⑤的氢化物沸点高于元素①的氢化物 | |
| D. | ⑧号元素位于周期表中第三周期第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该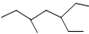 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. | 该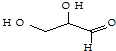 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,证明该溶液中一定不含有K+ | |
| B. | 将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2 | |
| C. | 向无色溶液中加入氯水,再加CCl4,振荡静置后CCl4层呈紫色,则原溶液中含I- | |
| D. | 向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com