
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 熔点/℃ | 64.7 | 249 | 199.6 |
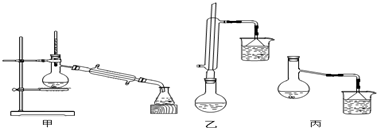
 C6H5COOCH3+H218O,
C6H5COOCH3+H218O, C6H5COOCH3+H218O;
C6H5COOCH3+H218O;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、B、D的最高价氧化物都不能和酸反应 |
| B、最高价氧化物对应的水化物的碱性:A>C |
| C、A的原子半径为这四种当中最小的 |
| D、四种元素中B形成化合物的种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
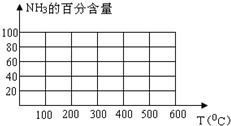 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:| 压强/Mpa NH3含量/% 温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 标准溶液(H2SO4)(aq) 浓度(mol/L) | 滴定完成时耗酸 体积V(mL) | 待测溶液(NaOH)(aq) 体积V(mL) |
| 1 | 1.000 | 11.00 | 25.00 |
| 2 | 1.000 | 12.04 | 25.00 |
| 3 | 1.000 | 12.18 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L的Na2HPO4溶液中存在如下的平衡;HPO42-?H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 |
| B、饱和NH4Cl中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3?H2O)+c(OH-) |
| C、常温下,0.1mol/L的HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混合后,所得溶液的pH≤7 |
| D、在NH4HSO3与NH4Cl混合溶液中:c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
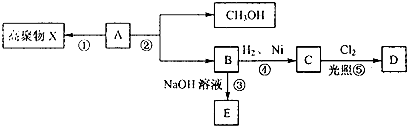
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的非金属性越强,它的氧化物的水化物的酸性就越强 |
| B、同一主族元素的原子序数可以相差34 |
| C、硅和硫熔化时所克服的作用类型相同 |
| D、分子晶体中分子间作用力越大,沸点越高,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com