
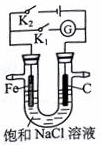
| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,立即有血红色出现 | |
| B. | K2闭合,电流方向由石墨棒经导线流向铁棒 | |
| C. | K2闭合,碳棒上发生还原反应,会生成黄绿色气体 | |
| D. | 将U型管支管封闭并闭合K1一段时间后,U型管中右侧液面会高于左侧液面 |
分析 若闭合K1,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;若闭合K2,该装置有外接电源,所以构成了电解池,Fe与负极相连为阴极,碳棒与正极相连为阳极,以此解答该题.
解答 解:A.若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe-2e-=Fe2+,则向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现,故A错误;
B.若闭合K2,该装置外接电源,所以构成了电解池;石墨棒作阳极,电流方向由铁棒经导线流向石墨棒,故B错误;
C.K2闭合,碳棒为阳极,碳棒上发生氧化反应,故C错误;
D.将U型管支管封闭并闭合K1一段时间后,构成了原电池,发生吸氧腐蚀,U型管中右侧压强减小,则液面会高于左侧液面,故D正确.
故选D.
点评 本题考查了原电池原理和电解池原理,为高频考点,侧重于学生的分析、计算能力的考查,能正确判断电池的类型及两极的反应是解本题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
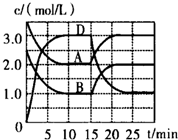 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
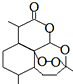 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 步骤① | 取适量NaOH固体放入烧杯中,加入适量的水,搅拌,插入一支温度计 测量溶液温度, | 溶液温度比室 温明显升高 | 氢氧化钠 固体溶于 水放热 |
| 步骤② | 步骤①所得的溶 液冷却到室温,用胶头滴管将稀盐酸滴入到步骤①所得的溶液中 | 溶液温度比室 温明显升高 | 氢氧化钠与稀盐 酸反应会放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量氨水 | B. | 向Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向NaAlO2溶液中加入过量稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
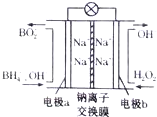 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 该电池的负极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 电极a采用Mn02作电极材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com