
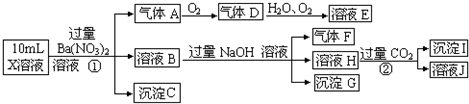
ijĒæĖįŠŌČÜŅŗX£¬ŗ¬ÓŠBa2+”¢Al3+”¢SiO32£”¢NH4+”¢Fe2+”¢Fe3+”¢
CO32£”¢SO42£”¢NO3£ÖŠµÄŅ»ÖÖ»ņ¼øÖÖĄė×Ó£¬Č”ČÜŅŗ½ųŠŠĮ¬ŠųŹµŃ飬ÄÜŹµĻÖČēĻĀ×Ŗ»Æ£ŗ

ŅĄ¾ŻŅŌÉĻŠÅĻ¢£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÉĻŹöĄė×ÓÖŠ£¬ČÜŅŗXÖŠæĻ¶Øŗ¬ÓŠµÄŹĒ£ŗ_____________________________£»²»ÄÜæĻ¶ØµÄŹĒ£ŗ_________________”£¶Ō²»ÄÜČ·¶ØŹĒ·ń“ęŌŚµÄĄė×Ó£¬æÉŅŌĮķČ”XČÜŅŗÓŚŅ»Ö§ŹŌ¹ÜÖŠ£¬Ń”ŌńĻĀĮŠŹŌ¼ĮÖŠµÄŅ»ÖÖ¼ÓČėXČÜŅŗÖŠ£¬øł¾ŻĻÖĻó¾ĶæÉÅŠ¶Ļ£¬ŌņøĆŹŌ¼ĮŹĒ£ŗ___________”££ØŃ”Ģī£ŗ¢ŁNaOHČÜŅŗ£¬¢Ś·ÓĢŖŹŌ¼Į£¬¢ŪŹÆČļŹŌ¼Į£¬¢ÜpHŹŌÖ½£¬¢ŻKSCNČÜŅŗ£¬¢ŽKMnO4ČÜŅŗ£©
£Ø2£©ĘųĢåFµÄ»ÆѧŹ½ĪŖ£ŗ_______________£¬³ĮµķGµÄ»ÆѧŹ½ĪŖ£ŗ_____________£¬³ĮµķK µÄ»ÆѧŹ½ĪŖ£ŗ____________£¬ŹµŃéÖŠ£¬æÉŅŌ¹Ū²ģµ½·“Ó¦¢ŚµÄĻÖĻóŹĒ£ŗ________________”£
£Ø3£©Š“³ö²½Öč¢ŁĖłÓŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½_________________”¢__________________”£
£Ø4£©ŅŖŹ¹²½Öč¢ŪÖŠ£¬D”¢H2O”¢O2ČżÖÖĪļÖŹĒ”ŗĆ·¢Éś»ÆŗĻ·“Ó¦£¬ŌņD”¢H2O”¢O2ĪļÖŹµÄĮæÖ®±ČŹĒ£ŗ______________________”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| H | + 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 4 |
| O | - 2 |
| O | - 3 |
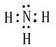
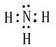
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā



²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2010-2011ѧğÕć½Ź”øßČżøßæ¼Ä£Äāæ¼ŹŌ£ØĄķ×Ū£©»Æѧ²æ·Ö ĢāŠĶ£ŗĢīæÕĢā
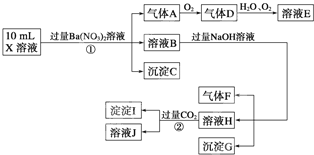
(15·Ö)ijĒæĖįŠŌČÜŅŗXæÉÄÜŗ¬ÓŠBa2+”¢A13+”¢NH4+”¢Fe2+”¢Fe3+”¢CO32£”¢SO32£”¢SO42£”¢C1£”¢NO2£”¢NO3£ÖŠµÄŅ»ÖÖ»ņ¼øÖÖ£¬Č”øĆČÜŅŗ½ųŠŠĮ¬ŠųŹµŃ飬ŹµŃé¹ż³ĢČēĻĀ£ŗ

øł¾ŻŅŌÉĻŠÅĻ¢£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ÉĻŹöĄė×ÓÖŠ£¬ČÜŅŗXÖŠ³żH£«Ķā»¹æĻ¶Øŗ¬ÓŠµÄĄė×ÓŹĒ ”ų £¬²»ÄÜČ·¶ØŹĒ·ńŗ¬ÓŠµÄĄė×Ó(M)ŹĒ ”ų £¬ČōŅŖČ·¶ØøĆM(Čō²»Ö¹Ņ»ÖÖ£¬æÉČĪŃ”Ņ»ÖÖ)ŌŚČÜŅŗXÖŠ²»“ęŌŚ£¬×īæÉææµÄ»Æѧ·½·ØŹĒ ”ų ”£
(2)³ĮµķIµÄ»ÆѧŹ½ĪŖ ”ų £¬ĘųĢåFµÄµē×ÓŹ½ĪŖ ”ų ”£
(3)Š“³öÉś³ÉAµÄĄė×Ó·½³ĢŹ½£ŗ ”ų ”£
(4)Ķس£æÉŅŌĄūÓĆKClOŌŚŅ»¶ØĢõ¼žĻĀŃõ»ÆGĄ“ÖʱøŅ»ÖÖŠĀŠĶ”¢øߊ§”¢¶ą¹¦ÄÜĖ®“¦Ąķ¼ĮK2FeO4”£ĒėŠ“³öÖʱø¹ż³ĢÖŠµÄĄė×Ó·½³ĢŹ½ ”ų ”£
(5)1.0mol/LµÄEČÜŅŗÓė2.0mol/LFČÜŅŗµČĢå»ż»ģŗĻĶźČ«·“·“Ó¦ŗó£¬ČÜŅŗÖŠø÷Ąė×ÓµÄÅØ¶Č“óŠ”¹ŲĻµĪŖ ”ų ”£
(6)¼ŁÉč²ā¶ØA”¢F”¢I¾łĪŖ0.10mol£¬50mL XČÜŅŗÖŠn(H£«)£½0.40mol£¬µ±³ĮµķCĪļÖŹµÄĮæ“óÓŚ0.70molŹ±£¬ČÜŅŗXÖŠ»¹Ņ»¶Øŗ¬ ”ų ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com