
| A. | K+ Na+ NO3- CO32- | B. | Na十 Fe3+ SCN- SO42- | ||
| C. | K+ Na十 Cl- AlO2- | D. | Al3+ Na+ Cl- SO42- |
分析 强酸性溶液中存在电离氢离子,
A.碳酸根离子与氢离子反应;
B.铁离子与硫氰根离子结合生成络合物硫氰化铁;
C.偏铝酸根离子与氢离子反应;
D.四种离子之间不反应,都不与氢离子反应.
解答 解:强酸性溶液中存在电离氢离子,
A.CO32-与强酸性溶液中的氢离子反应,在溶液中不能大量共存,故A错误;
B.Fe3+和SCN-之间反应生成硫氰化铁,在溶液中不能大量共存,故B错误;
C.AlO2-与强酸性溶液中的氢离子反应,在溶液中不能大量共存,故C错误;
D.Al3+、Na+、Cl-、SO42-之间不反应,都不与强酸性溶液中的氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒等技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 打磨磁石制作指南针为化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸或者SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃,可以得到硅酸沉淀 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高,硬度大 | |
| D. | 氢氟酸能够腐蚀玻璃,故不能用玻璃瓶来装氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
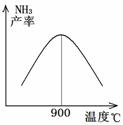 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示: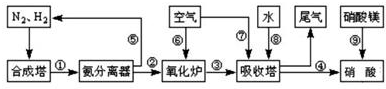
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往品红溶液中通入SO2 | B. | NO中混入空气 | ||
| C. | 往氨水中滴加酚酞 | D. | 往Ba(OH)2溶液中滴加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com