
【题目】在一定条件下,NO跟![]() 可以发生反应:
可以发生反应:![]() ,关于该反应下列说法中不正确的是()
,关于该反应下列说法中不正确的是()
A.![]() 既不是氧化产物也不是还原产物
既不是氧化产物也不是还原产物
B.该反应中被氧化和被还原的氮元素的质量比是2:3
C.若有![]() 完全反应,共转移12mol电子
完全反应,共转移12mol电子
D.NO是氧化剂,![]() 是还原剂
是还原剂
【答案】C
【解析】
在反应6NO+4NH3=5N2+6H2O中,NO中N元素由+2价降低为0,NH3中N元素的化合价由-3价升高为0,以此来解答。
A. 水中H、O元素的化合价在反应前后不变,则H2O既不是氧化产物也不是还原产物,A项正确;
B. NO中N元素由+2价降低为0,被还原,NH3中N元素的化合价由-3价升高为0,被氧化,则该反应中被氧化和被还原的氮元素的质量比是2:3,B项正确;
C. 由反应可知,4molNH3完全反应转移12mol电子,C项错误;
D. NO中N元素由+2价降低为0,NO为氧化剂,NH3中N元素的化合价由-3价升高为0,氨气为还原剂,D项正确;
答案选C。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】辉钼矿主要含MoS2,还含有Ca、Si、Cu、Zn、Fe等元素。利用辉钼矿制备仲钼酸铵的新一代清洁生产工艺如下图所示:
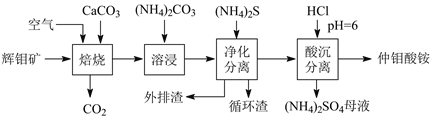
回答下列问题:
(1)焙烧温度为400℃,MoS2转化为CaMoO4和CaSO4,则反应中每摩MoS2转移的电子数为_________。仲钼酸铵(七钼酸铵)中的阴离子是Mo7O24n-,则n=_______。
(2)传统焙烧是在650℃下,使MoS2直接与空气中的O2反应生成MoO3和SO2。图示清洁生产工艺加入CaCO3的优点是______________。
(3)溶浸时,CaMoO4发生复分解反应的化学方程式是___________。循环渣的主要成分是CaCO3,则外排渣主要是________和Cu、Zn、Fe的硫化物。
(4)已知:常温下Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6。在(NH4)2SO4母液中添加循环渣(CaCO3),可以使硫酸铵转化为碳酸铵(返回溶浸循环使用),原因是_______。
(5)电氧化分解钼精矿时,用惰性电极电解钼精矿和NaCl的混合浆液,电解槽无隔膜,控制溶液pH=9。阴极生成物为________,混合浆液中,阳极产物转化生成的NaClO氧化MoS2生成MoO42-和SO42-的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示转化关系中涉及到的物质均由主族元素组成(部分产物已略去),其中C、D为单质,A、B、E、F、G为化合物,除C与D的反应外,其它反应均在溶液中进行。请填写下列空白。
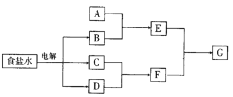
(1) 若A是常见的金属或金属氧化物,当F过量时,G为可溶性盐,则A的化学式为_________或_________。
(2) 若A是一种常见氧化物,不管F过量与否,G为同一种难溶性物质,则A的名称是________,晶体类型是_______,A的用途是_________。
(3) 若A是一种具有漂白性的气态氧化物,A是___;若A是一种无味的气态氧化物,A的电子式为______。
(4) 若A为有机化合物,如果A与G为同一物质,请写出两种A(不同类别物质)的结构简式:_____;_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
I.可利用CH4与CO2制备合成气(CO、H2),在某一钢性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-A12O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)=2CO(g)+2H2(g)
(1)研究表明CO的生成速率![]() ,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=_________。
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
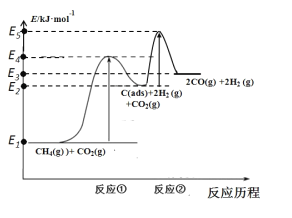
CH4与CO2制备合成气的热化学方程式为__________________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.CO2催化加氢制甲醇5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2,发生以下反应:
i. ![]() ,
,![]()
ii.. ![]()
iii. ![]()
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如右图所示。
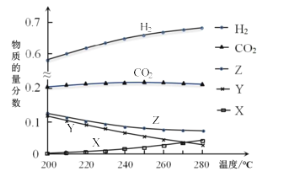
(4)①体系中CO2的物质的量分数受温度的影响不大,原因是_______________________。
②下列措施中,无法提高甲醇平衡产率的是________(填标号)。
A.加入适量CO B.增大压强C.循环利用原料气D.升高温度
③如上图X、Y分别代表_________、________(填化学式)。
III.利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
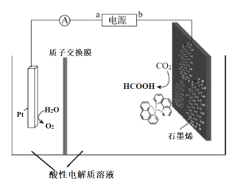
(5)①电池工作过程中,图中Pt电极附近溶液的pH_______(填“变大”或“变小”),阴极的电极反应式为________________。
②每转移2mol电子,阴极室溶液质量增加______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的模型如下图(图中的连线表示化学键),下列说法正确的是( )
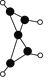
A. X能使溴的四氯化碳溶液褪色
B. X是一种在常温下能稳定存在的液态烃
C. X分子中在同一平面上的碳原子最多有5个
D. 充分燃烧等质量的X和甲烷,X消耗氧气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图。回答下列问题。
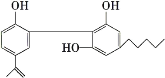
①它的化学式为____。
②从结构上看,它属于___类。
③它所含的官能团的名称是___。
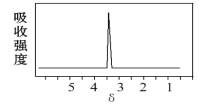
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图:则A的名称为___;请预测B的核磁共振氢谱上有___个峰(信号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2 溶液、盐酸四种无色溶液中的一种,现进行了如图所示的实验。

(1)通过上述实验判断出各物质:甲___、乙___、丙___、丁____。写出甲与乙反应的离子方程式:___。
(2)实验室有一瓶标签破损(如图所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确? _____(填“正确”或“不正确”)。若正确,请写出相应反应的离子方程式__________;若不正确, 请说明可能的结论:_______(填物质的化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
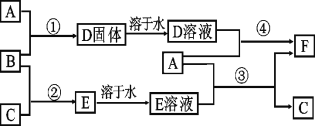
请回答:
(1)写出B物质的化学式:_______;F的化学名称:_______。
(2)写出第②步C在B中燃烧的反应现象:_______。
(3)写出第④步反应的化学反应方程式_______。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____,写出该反应的化学方程式_____________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com