
| ||
. |
| ||
. |

| c(HCO3-)?c(OH-) |
| c(CO32-) |
| c(HCO3-)?c(OH-) |
| c(CO32-) |
| 0.01×0.01 |
| 0.5 |
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、S2-、Na+、SO32-、Cl- |
| B、Ca2+、NH4+、SO42-、SiO32- |
| C、Na+、Ba2+、Cl-、HSO3- |
| D、Al3+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
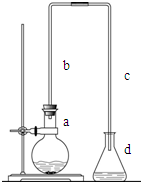 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 加入盐酸的体积 | 沉淀的质量 |
| 1 | 60mL | 0 |
| 2 | 80mL | 0.78g |
| 3 | 100mL | 5.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com