
【题目】表是25℃时四种酸的电离平衡常数:
化学式 | CH3COOH | HA | HNO2 | H2CO3 |
Ka | Ka=1.8×10﹣5 | Ka=4.9×10﹣10 | Ka=4.6×10﹣4 | Ka1 =4.1×10﹣7 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)25℃时,向向0.1molL﹣1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液pH=
(3)写出NaA溶液中通少量CO2的离子方程式
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2 , 某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法(填“可行”或“不可行”),理由是
(6)已知NaHCO3溶液中存在HCO3H++CO32﹣ , 加水稀释时溶液中的c(H+)将(填“增大”或“减小”)
【答案】
(1)NO2﹣+H2O?HNO2+OH-
(2)5
(3)A﹣+CO2+H2O=HA+HCO3﹣
(4)c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
(5)可行; NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行
(6)增大
【解析】解:(1)用离子方程式表示NaNO2溶液是强碱弱酸盐,水解溶液呈碱性,方程式为:NO2﹣+H2OHNO2+OH﹣,所以答案是:NO2﹣+H2OHNO2+OH﹣;(2)醋酸的电离平衡常数Ka=1.8×10﹣5= ![]() ,已知c(CH3COOH):c(CH3COO﹣)=5:9,则c(H+)=1.8×10﹣5×
,已知c(CH3COOH):c(CH3COO﹣)=5:9,则c(H+)=1.8×10﹣5× ![]() =1×10﹣5mol/L,则该溶液的pH=5,所以答案是:5;(3)由电离平衡常数可知,酸性H2CO3>HA>HCO3﹣,所以NaA溶液中通少量CO2的离子方程式为:A﹣+CO2+H2O=HA+HCO3﹣,
=1×10﹣5mol/L,则该溶液的pH=5,所以答案是:5;(3)由电离平衡常数可知,酸性H2CO3>HA>HCO3﹣,所以NaA溶液中通少量CO2的离子方程式为:A﹣+CO2+H2O=HA+HCO3﹣,
所以答案是:A﹣+CO2+H2O=HA+HCO3﹣;(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,HA的Ka=4.9×10﹣10,所以NaA的水解Kh= ![]() >Ka,所以水解大于电离,以水解为主溶液呈碱性,所以离子浓度大小为:c(Na+)>c(A﹣)>c(OH﹣)>c(H+),所以答案是:c(Na+)>c(A﹣)>c(OH﹣)>c(H+);(5)醋酸微弱电离出氢离子与NO2﹣结合成HNO2,而HNO2不稳定,在稀溶液中也易分解生成NO与生成红棕的NO2,
>Ka,所以水解大于电离,以水解为主溶液呈碱性,所以离子浓度大小为:c(Na+)>c(A﹣)>c(OH﹣)>c(H+),所以答案是:c(Na+)>c(A﹣)>c(OH﹣)>c(H+);(5)醋酸微弱电离出氢离子与NO2﹣结合成HNO2,而HNO2不稳定,在稀溶液中也易分解生成NO与生成红棕的NO2,
所以答案是:可行,NaNO2+CH3COOHCH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行;(6)NaHCO3溶液中HCO3的水解程度大于电离程度,溶液显碱性,加水稀释时溶液碱性减弱,氢离子浓度增大,所以答案是:增大.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
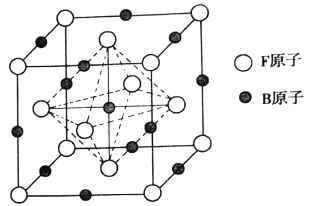
【题目】A、B、C、D、E、X、F是周期表中前四周期的七种元素,它们的原子序数依次增大。A元素的核外电子数和电子层数相等,是宇宙中最丰富的元素。B的最外层电子数为其内层电子数的2倍,D基态原子的s能级和p能级上电子数相等,E在短周期元素中第一电离能最小,X与D同主族,F在周期表的第八列。
(1)基态F原子的核外有_______种运动状态的电子。基态F3+的最外层电子排布式是________。
(2)B、C、D三种元素的电负性由大到小的排列是_______(填元素符号)。
(3)A、B、D形成BA2D型分子,该分子的空间构型为________。
(4)BC-中B原子的杂化轨道类型是_______,该离子中含有的σ键与π键的数目之比为_____。写出一种与该分子互为等电子体的单质分子的结构式_______。
(5)E2X与E2D相比较熔点较高的是______(填化学式),原因是__________。
(6)奧氏体是B溶解在F中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为_______。若晶体密度为dg.cm-3,则晶胞中最近的两个B原子的距离为______pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅根据题中图示得出的结论不合理的是( )
A | B | C | D | |
图示 |
|
|
|
|
结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y和Z之间的有__________________。
(3)Y和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。

(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验: ①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4 , 用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL.
(1)若滴定终点时仰视读数,则所测x的值将(填“偏大”或“偏小”).
(2)x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠和硫酸溶液等体积混合后,H+浓度为0.3 mol·L-1,SO42-浓度为0.4 mol·L-1,则混合溶液中Na+浓度为
A.0.05 mol·L-1B.0.2 mol·L-1C.0.5 molD.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下S2Cl2是橙黄色液体,其分子结构如图所示.少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液.下列关于S2Cl2的说法错误的是( ) 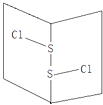
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O→SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题..
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
二 | C | N | O | Ne | ||||
三 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为 .
(2)H2SO4与HClO4中,酸性较强的是 .
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是 . 它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是
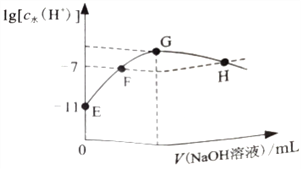
A. 用pH试纸测定E点对应的溶液,其pH=3
B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-)
C. 加水稀释H点对应的溶液,溶液的pH增大
D. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com