

分析 (1)A名称是蒸馏烧瓶;产品易溶于水难溶于乙醇;
(2)硫代硫酸钠遇酸反应生成硫、二氧化硫和水;
(3)SO2、Na2S和Na2CO3反应生成Na2S2O3,结合质量守恒确定产物并配平;
(4)加入盐酸,Na2S2O3反应生成S沉淀,静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子;
(5)淀粉遇碘变蓝色,其它物质遇碘不变蓝色;消耗碘的标准溶液体积=(18.50-2.50)mL=16.00mL,根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后碘单质的物质的量计算出Na2S2O3•5H2O质量及产品的纯度.
解答 解:(1)根据仪器A的结构特点知A的名称为蒸馏烧瓶;产品易溶于水,难溶于乙醇,步骤 ④中洗涤时,为了减少产物的损失用的试剂可以是乙醇;
故答案为:蒸馏烧瓶;乙醇;
(2)Na2S2O3在酸性条件下会生成S和二氧化硫,所以产率会下降,其反应的离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑;
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(3)三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式为:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
故答案为:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
(4)检测产品中是否存在Na2SO4的实验方案为:取少量产品溶于足量稀盐酸、静置、取上层清液滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
故答案为:取少量产品溶于足量稀盐酸、静置、取上层清液滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(5)淀粉遇碘变蓝色,其它物质遇碘不变蓝色,所以滴定终点现象是:滴入最后一滴标准液时,溶液由无色变为蓝色,且半分钟内不再褪色;
消耗碘的标准溶液体积=(18.50-2.50)mL=16.00mL,n(I2)=0.100 0mol•L-1×0.0016L=1.6×10-4mol,根据2S2O32-+I2═S4O62-+2I-可知知n(Na2S2O3•5H2O)=3.2×10-4mol,m(Na2S2O3•5H2O)=0.7936g,产品的纯度为,其纯度=$\frac{0.7936g}{1.00g}$×100%=79.36%;
故答案为:滴入最后一滴标准液时,溶液由无色变为蓝色,且半分钟内不再褪色;16.00;79.36%.
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作、实验分析、评价及计算能力,明确实验原理、实验方法、元素化合物性质是解本题关键,注意(5)题碘溶液体积书写方式(保留小数点后2位),题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
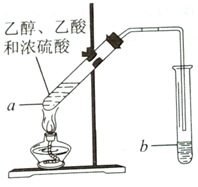 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
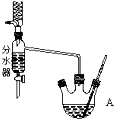 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
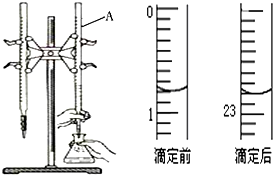 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com