
【题目】【2017沙坪坝区校级模拟】下列说法中可以证明反应H2(g)+I2(g)2HI(g)已达平衡状态的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H﹣H键断裂的同时有两个H﹣I键断裂
③百分含量w(HI)=w(I2)
④反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内的压强不再变化
⑧条件一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化.
A.②⑥⑨ B.①②③④ C.②⑥⑨⑩ D.③⑤⑥⑦⑧
【答案】A
【解析】①单位时间内生成n mol H2的同时生成2n mol HI,才是平衡状态,故错误;②一个H﹣H键断裂等效于生成两个H﹣I同时有两个H﹣I键断裂,正逆反应速率相等,达平衡状态,故正确;③百分含量不变,而不是w(HI)=w(I2),故错误;④只要反应发生就有反应速率v(H2)=v(I2)=![]() v(HI),故错误;⑤当体系达平衡状态时,c(HI):c(H2):c(I2)可能为2:1:1,也可能不是2:1:1,与各物质的初始浓度及转化率有关,故错误;⑥温度和体积一定时,生成物浓度不再变化,正逆反应速率相等,达平衡状态,故正确;⑦温度和体积一定时,两边气体计量数相等,容器内的压强始终不再变化,故错误;⑧条件一定时,两边气体计量数相等,混合气体的平均相对分子质量始终不再变化,故错误;⑨温度和体积一定时,混合气体颜色不再变化,正逆反应速率相等,达平衡状态,故正确;⑩温度和压强一定时,混合气体的密度不再变化,说明相对分子量不变,而两边气体计量数相等,混合气体的平均相对分子质量始终不再变化,故错误;故选A。
v(HI),故错误;⑤当体系达平衡状态时,c(HI):c(H2):c(I2)可能为2:1:1,也可能不是2:1:1,与各物质的初始浓度及转化率有关,故错误;⑥温度和体积一定时,生成物浓度不再变化,正逆反应速率相等,达平衡状态,故正确;⑦温度和体积一定时,两边气体计量数相等,容器内的压强始终不再变化,故错误;⑧条件一定时,两边气体计量数相等,混合气体的平均相对分子质量始终不再变化,故错误;⑨温度和体积一定时,混合气体颜色不再变化,正逆反应速率相等,达平衡状态,故正确;⑩温度和压强一定时,混合气体的密度不再变化,说明相对分子量不变,而两边气体计量数相等,混合气体的平均相对分子质量始终不再变化,故错误;故选A。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,但在198℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有:①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A. ①②③④⑤B. ①③④⑥C. ②③④⑤D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
A. 硫酸,纯碱,石灰石 B. 醋酸,烧碱,硫酸铜
C. 磷酸,熟石灰,苛性钠 D. 醋酸,小苏打,熟石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017河东区二模】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
![]()
A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C.若x<3,C的平衡浓度关系为:c(M)>c(N)
D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g 含NaOH样品溶解在bmL 0.l mol·L-1的硫酸中,再加入cmL 0.1 mol·L-1 的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是
A. [(b-c)/125a]×100%B. [(b-2c)/125a]×100%
C. [(b-c)/250a]×100%D. [(8b-8c)/a]×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.凡能发生银镜反应的有机物一定是醛
B.在氧气中燃烧时只生成CO2和H2O的物质一定是烃
C.苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸
D.在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢而生成水和酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017江苏] H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
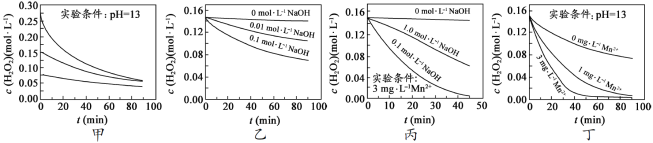
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com