
| A、②和③ | B、②和① |
| C、③和① | D、④ |
科目:高中化学 来源: 题型:
| 还原 |
| ①NaCN |
| ②H+ |
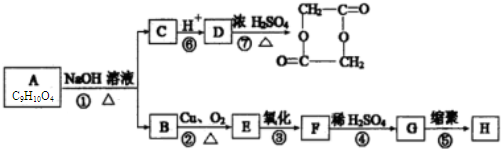

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤代烃在NaOH溶液加热时水解生成的有机物都是醇 |
| B、所有的一元醇都能被氧化为具有相同碳原子数的醛或酮 |
C、 与 与  互为同系物 互为同系物 |
| D、由摩尔质量相等的一元羧酸和一元醇形成的酯C9H18O2的同分异构体共有16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是放热反应都是自发的,吸热反应都是非自发的 |
| B、自发反应一定是△S>0,非自发反应一定是△S<0 |
| C、△S>0且放热的反应一定是自发反应 |
| D、非自发反应在任何条件下都不能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O是一种非常稳定的化合物,这是由于氢键所致 |
| B、CaO2晶体中阳离子与阴离子数目之比为1:2 |
| C、由ⅠA族和ⅥA族短周期元素形成的原子个数比为1:1,电子总数为38的化合物,是含有极性键的离子型化合物 |
| D、元素周期表中,除第一和第七周期外,第n周期所含金属元素(包括稀有气体元素)的种数均为(8-n) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤素单质与水反应均可用X2+H2O═HXO+HX表示 |
| B、HX都极易溶于水,它们的热稳定性随着核电荷数的增加而增强 |
| C、从F2到I2,卤素单质的颜色随着相对分子质量的增大而加深 |
| D、X-离子的还原性F-<Cl-<Br-<I-,因此,相对分子质量小的卤素单质可将相对分子质量大的卤素从它的盐溶液里置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W | Q |
| A、钠与Y可能形成Na2Y2化合物 |
| B、Z的最高价含氧酸比X的最高价含氧酸的酸性强 |
| C、W得电子能力比Q强 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com