
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④ |
分析 ①根据CH3-CH=CH2和CH2=CH2的最简式都是CH2进行判断;
②CH≡CH和C6H6的最简式相同,所以含碳量相同;
③结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
④核磁共振氢谱法用于测定有机物分子中氢原子种类,质谱仪可以快速、微量、精确的测定相对分子质量.
解答 解:①CH3-CH=CH2和CH2=CH2的最简式的是CH2,二者的最简式相同,故①正确;
②CH≡CH和C6H6的最简式的是CH,所以二者的含碳量相同,故②正确;
③戊烯和丁烯为单烯烃,二者的结构相似,属于同系物,故③正确;
④能够快速、微量、精确的测定相对分子质量的物理方法是质谱仪,不是核磁共振氢谱,故④错误;
故选D.
点评 本题考查了常见化学用语的判断,题目难度不大,注意掌握同系物、同分异构体、同位素、同素异形体的概念及判断方法,明确各概念的区别.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图(1)是N2(g)+3H2(g)?2NH3(g)的化学平衡图象,在t0时刻充入一定量的NH3,平衡逆向移动 | |
| B. | 图(3)表示的化学方程式为2A═B+3C | |
| C. | 图(2)中p2>p1,T1>T2 | |
| D. | 图(4)对应反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸→SO3→石墨→Na2CO3•10H2O | B. | NaCl→NH3→铜→空气 | ||
| C. | 蔗糖→CuSO4→N2→Fe(OH)3胶体 | D. | KCl→CaO→液氯→石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$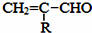
 的相对分子质量大2,则符合下列条件的G的同分异构体有3种.
的相对分子质量大2,则符合下列条件的G的同分异构体有3种. 的合成路线
的合成路线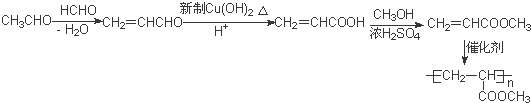 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1| A. | 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1mol N2和3mol H2,反应后放出的热量为Q1 kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com