
| A. | 氟化氢的电子式: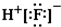 | B. | HClO的结构式:H-Cl-O | ||
| C. | 甲基的电子式 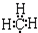 | D. | 基态氧原子L层电子排布图: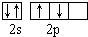 |
分析 A.氟化氢为共价化合物;
B.次氯酸的中心原子是氧原子,分子中不存在氢氯键;
C.甲基中含有3个碳氢键,碳原子最外层含有7个电子;
D.2p电子的自旋方向相同时具有最低能量.
解答 解:A.氟化氢中不存在阴阳离子,其电子式不能标出电荷,氟化氢正确的电子式为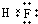 ,故A错误;
,故A错误;
B.次氯酸的中心原子是氧原子,正确的结构式为H-O-Cl,故B错误;
C.甲基为甲烷失去1个H原子形成的,碳原子最外层为7个电子,甲基的电子式为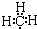 ,故C正确;
,故C正确;
D.氧原子的L层电子的2p轨道电子的自旋方向应该相同,基态氧原子L层电子排布图为 故D错误,
故D错误,
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,选项B中需要明确次氯酸的中心原子是O元素,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫在空气中燃烧,产生蓝紫色火焰 | |
| B. | 将二氧化碳通入水中,无明显现象 | |
| C. | 红亮的铜丝在酒精灯火焰上灼烧,铜丝表面变黑 | |
| D. | 一氧化碳通过灼热的氧化铁,红色固体变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
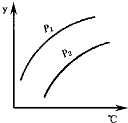 如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )
如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )| A. | 一定条件下L的转化率 | B. | 气体混合物的平均摩尔质量 | ||
| C. | 气体混合物中L的体积分数 | D. | 气体L的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相差一个或若干个CH2原子团的化合物必定互为同系物 | |
| B. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| C. | 具有相同通式的有机物不一定互为同系物 | |
| D. | 两个相邻同系物的相对分子质量数值一定相差14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
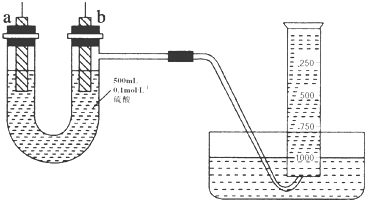
 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m2、m5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com