
【题目】25°C 时,向 10 mL 0.10 mol·L-1 的 HA (Ka =1.0×10-4)中逐滴加入 0.10 mol·L-1NaOH 溶液,溶液 pH 随滴入的 V[(NaOH)aq]变化如下图所示。下列说法正确的是
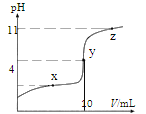
A.x 点,c(HA)> c(A-)
B.y 点,c(HA)+c(A-)=c(Na+) =0.10 mol·L-1
C.z 点,c(Na+) = c(A-) + c(OH-)
D.水的电离程度,x 点小于 y 点
【答案】D
【解析】
A.若x点对应所加入NaOH溶液的体积为5mL,NaA、HA的物质的量浓度相等,由于溶液呈酸性,HA的电离程度大于NaA的水解程度,c(HA)<c(A-),A错误;
B.若忽略体积变化,y点加入NaOH溶液的体积为10mL,溶液的总体积为20mL,c(HA)+ c(A-)=c(Na+)=0.05 mol·L-1,B错误;
C.z点时,由电荷守恒可知,c(H+)+ c(Na+)= c(A-)+c(OH-),C错误;
D.x点时溶液中的溶质是NaA、HA;y点时溶液中的溶质是NaA,y点时溶液中的NaA的物质的量浓度比x点时溶液中的NaA的物质的量浓度大,能够水解的盐促进水电离,故水的电离程度,x点小于y点,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】O3是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是( )

A.电极a为阴极
B.a极的电极反应为O2+4H++4e-═2H2O
C.电解一段时间后b极周围的pH上升
D.标准状况下,当有5.6LO2反应时,收集到O2和O3混合气体4.48L,O3的体积分数为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由1.3-丁二烯可制备醇酸树脂的原料M以及杀菌剂N,其合成路线如图:
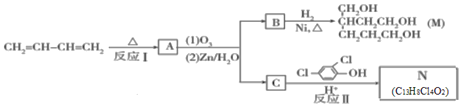
已知:i.Diels-AIder反应: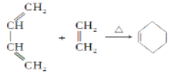
ii.RHC=CHR′![]() RCHO+ R′CHO(R、R′代表羟基或氢)
RCHO+ R′CHO(R、R′代表羟基或氢)
iii.A是一个六元环状化合物;lmol C能与2mol![]() 反应生成N。
反应生成N。
(1)N中含有的官能团名称为_______。
(2)CH2=CH—CH=CH2 能发生加聚反应生成顺式聚合物,请写出该顺式聚合物的结构简式:________。
(3)反应I的化学方程式是__________;该反应的反应类型为_________。
(4)lmol B完全转化成M所消耗的H2的质量是______g。
(5)反应II的化学方程式是________.
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式:_____。
(7)已知:乙快与1, 3-丁二烯也能发生Diels-AIder反应。请以1, 3-丁二烯和乙炔为原料,选用必要的无机试剂合成丙二酸,写出合成路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
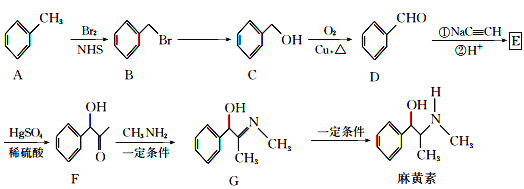
【题目】“麻黄素”是中枢神经兴奋剂,其合成路线如图所示:
已知:CH3C![]() CH+H2O
CH+H2O![]()
(1)F中的官能团的名称为__。
(2)B→C的反应条件是__,反应类型是__,E的结构简式为__。
(3)写出C→D的化学反应方程式__。
(4)麻黄素的分子式为__。
(5)H是G的同系物,也含醇羟基和碳氮双键,相对分子质量比G小28,且苯环上仅有一个侧链,则H的可能结构有___种(不考虑![]() 结构)。
结构)。
(6)已知:R-C![]() C-R
C-R![]() R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂
R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂![]() 的合成路线,其它试剂及溶剂任选__。
的合成路线,其它试剂及溶剂任选__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上
(1)0.0005 mol/L的氢氧化钡溶液的pH=____________
(2)pH=4的HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol·L-1
(3)pH=4的NH4Cl溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol/L
(4)pH相同的下列溶液:①盐酸、②醋酸,分别与足量且表面积相同的锌片反应,反应起始时生成气体的速率_______(选用“①快”或“②快”或“一样快”或“无法判断”填写),最终生成气体的体积_______。(选用“①多”或“②多”或“一样多”或“无法判断”填写)
(5)用离子方程式表示FeCl3溶液显酸性的原因:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。 一种钙钛矿太阳能电池材料的晶胞如图所示。

请按要求回答下列有关问题:
(1)构成 CH3NH3 的三种元素中电负性最小的是_____________; 写出碳原子的电子排布式为__________。
(2)Pb 与 C 同主族,比 C 的周期序数大 4,写出 Pb 原子最外层电子的轨道表示式(即电子排布图)__________________。
(3)有关 NH3 的结构与性质探究
① NH3 分子中所含化学键是____________(从“极性键”、“非极性键”、“配位键”、 “离子键”、“σ键”或“ π键”中选填符合的名称);N 原子的杂化形式为__________。
② NH3 分子的 VSEPR 模型名称为_________,分子的空间结构(即立体构型) 为______。
③如图所示,探究 NH3 的性质时,打开止水夹,挤压胶头滴管,可以观察到烧瓶中迅速产生红色喷泉。请用必要的分子结构 与性质的知识和化学用语解释产生该现象的原因:_________、________。

(4)该钙钛矿太阳能电池材料的化学式为________________;该晶胞中,与 I- 紧邻的 I- 个数为_____________; 测定其晶体结构特征最可靠的方法是____________实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容的密闭容器中充入0.1mol/LCO2、0.1mol/LCH4,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如图,下列有关说法不正确的是( )
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如图,下列有关说法不正确的是( )

A.上述反应的ΔH>0
B.压强:p4>p3>p2>p1
C.1100℃时该反应平衡常数约为1.64
D.压强为p4时,在y点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是中学化学中常见的气体,其用途广泛。
(1)工业上氨气可以由氢气和氮气合成。
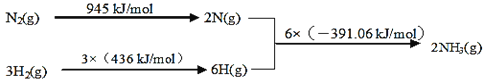
①该反应的热化学方程式是___。
②450℃,将5molN2和5molH2充入2L恒容密闭容器中发生反应,5min后达到平衡,N2的转化率为20%,则NH3的化学反应速率v(NH3)=___,该温度下如图所示反应的平衡常数的数值K=___,温度升高,平衡常数K将___(填“增大”、“减小”或“不变”)。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8LSO2时,溶液中的溶质为___。
②已知NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是___。
A.c(NH4+)=2c(SO32-)+c(HSO3-)
B.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
C.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
D.c(NH4+)+c(NH3·H2O)=c(SO32-)+c(HSO3-)+c(H2SO3)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择___(填“酸性”、“碱性”或“中性”)溶液。
②氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的总反应方程式为___,正极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C4H10O)是一种有机溶剂,且A只有一种一氯取代物B,在一定条件下A可以发生如下变化:
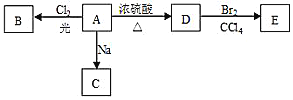
(1)A分子中的官能团名称是___,A的结构简式是___;
(2)写出下列化学方程式:
A→B:___;A→D:___;
(3)A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com