
分析 (1)氨水中一水合氨存在电离平衡,加入硫酸铵溶液中铵根离子浓度增大,平衡逆向进行;
(2)对于0.10mol•L-1的氨水,若向氨水中加入等体积PH=1的硫酸,恰好反应生成硫酸铵,溶液中铵根离子水解显酸性;
(3)溶液中存在电荷守恒分析,电离平衡常数K=$\frac{[O{H}^{-}][N{{H}_{4}}^{+}]}{[N{H}_{3}•{H}_{2}O]}$,结合溶液呈中性和c(NH4+)=176c(NH3•H2O)计算得到;
(4)结合一水合氨电离平衡常数计算溶液中氢氧根离子浓度,利用氯化钙溶液中钙离子浓度计算此时的浓度商Q和溶度积常数Ksp比较判断是否有沉淀生成.
解答 解:(1)氨水溶液中存在电离平衡,NH3•H2O?NH4++OH-,若向氨水中加入少量硫酸铵固体,铵根离子浓度增大,平衡逆向进行,氢氧根离子浓度减小,溶液的pH将减小,
故答案为:减小;NH3•H2O?NH4++OH-,加入硫酸铵后浓度增大,平衡逆向移动,使得OH-浓度减小,从而使PH减小
(2)对于0.10mol•L-1的氨水,若向氨水中加入等体积PH=1的硫酸,恰好反应生成硫酸铵,溶液中铵根离子水解显酸性,溶液PH<7,NH4++H2O?NH3•H2O+H+,溶液中离子浓度大小为:c(NH4+)>c(SO42-)c(H+)>c(OH-),
故答案为:<;NH4++H2O?NH3•H2O+H+;c(NH4+)>c(SO42-)c(H+)>c(OH-);
(3)溶液中存在电荷守恒:c(NH4+)+c(H+)=2c(SO42- )+c(OH-),向氨水中加入0.05mol•L-1稀硫酸至溶液正好呈中性,c(H+)=c(OH-),c(NH4+)=2c(SO42-),此时混合溶液中c(NH4+)=176c(NH3•H2O),则NH3•H2O的电离常数Kb=$\frac{[O{H}^{-}][N{{H}_{4}}^{+}]}{[N{H}_{3}•{H}_{2}O]}$=$\frac{1{0}^{-7}×176[N{H}_{3}•{H}_{2}O]}{[N{H}_{3}•{H}_{2}O]}$
=1.76×10-5,
故答案为:=;1.76×10-5;
(4)NH3•H2O的电离平衡常数为1.8×10-5,K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.8×10-5,c2(OH-)=3.6×10-6,10mL 0.02mol•L-1的CaCl2溶液中c(Ca2+)=0.02mol/L,Qc=c(Ca2+)×c2(OH-)=0.02mol•L-1×3.6×10-6=1.44×10-6mol/L<Ksp 无沉淀生成,
答:c2(OH-)=3.6×10-6,10mL 0.02mol•L-1的CaCl2溶液中c(Ca2+)=0.02mol/L,Qc=c(Ca2+)×c2(OH-)=0.02mol•L-1×3.6×10-6=1.44×10-6mol/L<Ksp 无沉淀生成,
点评 本题考查的是弱电解质的电离及离子浓度大小的比较、电离平衡常数计算、溶度积常数计算等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
| B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
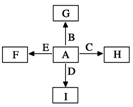 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物. ,它的空间构型是直线型分子;
,它的空间构型是直线型分子;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com