
ЁОЬтФПЁПШчЭМБэЪОAEЮхжжЮяжЪМфЕФЯрЛЅзЊЛЏЙиЯЕЃЌЦфжаAЮЊЕЛЦЩЋЙЬЬхЃЌBЮЊЕЅжЪЁЃЪдЭЦГіИїЮяжЪЕФЛЏбЇЪНЃЌВЂаДГіBЁњCЁЂCЁњDЁЂDЁњEЗДгІЕФЛЏбЇЗНГЬЪНЁЃ
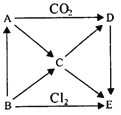
(1)аДГіBЁњCЁЂCЁњDЁЂDЁњEЗДгІЕФЛЏбЇЗНГЬЪНЃК
BЁњCЃК_______________ЃЛ
CЁњDЃК_______________ЃЛ
DЁњEЃК_______________ЃЛ
(2)НЋ3.9 gAЭЖШыЕНзуСПЕФЫЎжаГфЗжЗДгІЃЌЩњГЩЕФЦјЬхдкБъзМзДПіЯТЕФЬхЛ§ЮЊ_____LЃЌНЋЗДгІКѓЕФШмвКХфГЩ1000mLШмвКЃЌЫљЕУШмвКЕФЮяжЪЕФБмХЈЖШЮЊ______________ЁЃ
ЁОД№АИЁП 2NaЃЋ2H2O=2NaOHЃЋH2Ёќ 2NaOHЃЋCO2=Na2CO3ЃЋH2O Na2CO3ЃЋ2HCl=2NaClЃЋCO2ЁќЃЋH2O 0.56 0.1 molЁЄL-1
ЁОНтЮіЁПBЪЧЕЅжЪЃЌAЮЊЕЛЦЩЋЙЬЬхЃЌAФмКЭCO2ЗДгІЃЌдђAЪЧNa2O2ЃЌBФмКЭТШЦјЗДгІЃЌдђBЪЧNaЁЂEЪЧNaClЃЌAКЭЖўбѕЛЏЬМЗДгІЩњГЩNa2CO3КЭO2ЃЌDФмзЊЛЏЮЊNaClЃЌдђDЪЧNa2CO3ЃЌAЁЂBФмзЊЛЏЮЊCЃЌCФмзЊЛЏЮЊEКЭDЃЌдђCЪЧNaOHЁЃ
(1)BЪЧNaЃЌПЩгыЫЎЗДгІЩњГЩNaOHЃЌЗДгІЛЏбЇЗНГЬЪНЮЊ2Na+2H2OЈT2NaOH+H2ЁќЃЌЧтбѕЛЏФЦгыЖўбѕЛЏЬМЗДгІПЩвдЩњГЩЬМЫсФЦЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ2NaOHЃЋCO2=Na2CO3ЃЋH2OЃЛ
DЪЧNa2CO3ЃЌПЩгыбЮЫсЗДгІЩњГЩNaClЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊNa2CO3+2HClЈT2NaCl+H2O+CO2ЁќЃЌЙЪД№АИЮЊЃК2Na+2H2OЈT2NaOH+H2ЁќЃЛ2NaOHЃЋCO2=Na2CO3ЃЋH2OЃЛNa2CO3+2HClЈT2NaCl+H2O+CO2ЁќЃЛ
(2)n(Na2O2)=![]() =0.05molЃЌ
=0.05molЃЌ
дђ 2Na2O2+2H2O=4NaOH+O2Ёќ
2mol 36g 4mol 22.4L
0.05mol m(H2O)n(NaOH) V(O2)
V(O2)=![]() =0.56LЃЌn(NaOH)=
=0.56LЃЌn(NaOH)=![]() =0.1molЃЌc(NaOH)=
=0.1molЃЌc(NaOH)=![]() =0.1mol/LЃЌЙЪД№АИЮЊЃК0.56ЃЛ0.1ЁЃ
=0.1mol/LЃЌЙЪД№АИЮЊЃК0.56ЃЛ0.1ЁЃ


 жБЭЈЙѓжнУћаЃжмВтдТПМжБЭЈУћаЃЯЕСаД№АИ
жБЭЈЙѓжнУћаЃжмВтдТПМжБЭЈУћаЃЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉФГаЁзщФтгУЫсадKMnO4ШмвКгыH2C2O4ШмвКЕФЗДгІЃЈДЫЗДгІЮЊЗХШШЗДгІЃЉРДЬНОПЁАЬѕМўЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЌВЂЩшМЦСЫШчЯТЕФЗНАИМЧТМЪЕбщНсЙћЃЈКіТдШмвКЛьКЯЬхЛ§БфЛЏЃЉЁЃ
ЯобЁЪдМСКЭвЧЦїЃК0.20 mol/L H2C2O4ШмвКЁЂ0.010 mol/L KMnO4ШмвКЃЈЫсадЃЉЁЂMnSO4ЁЂеєСѓЫЎЁЂЪдЙмЁЂСПЭВЁЂУыБэЁЂКуЮТЫЎдЁВлЁЃ
ЮяРэСП БрКХ | VЃЈ0.20 mol/L H2C2O4ШмвКЃЉ/mL | VЃЈеєСѓЫЎЃЉ/mL | VЃЈ0.010 mol/LЫсадKMnO4ШмвКЃЉ/mL | mЃЈMnSO4ЃЉ/g | T/Ёц | вв |
Ђй | 2.0 | 0 | 4.0 | 0 | 50 | |
Ђк | 2.0 | 0 | 4.0 | 0 | 25 | |
Ђл | 1.5 | a | 4.0 | 0 | 25 | |
Ђм | 2.0 | 0 | 4.0 | 0.1 | 25 |
ЛиД№ЯТСаЮЪЬтЃК
ЂйаДГіЩЯЪіЗДгІЕФРызгЗНГЬЪНЃК________________________ЁЃ
ЂкЩЯЪіЪЕбщЂйЂкЪЧЬНОП____________ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЛЩЯЪіЪЕбщЂкЂмЪЧЬНОП____________ЖдЛЏбЇЗДгІЫйТЪ
гАЯьЁЃШєЩЯЪіЪЕбщЂкЂлЪЧЬНОПХЈЖШЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЌдђaЮЊ______________ЃЛБэИёжаЕФЁАввЁБЬюаДt/sЃЌЦфВтСПЕФЪЧ______________________ЁЃ
ЂлЪЕбщЂйжаЖдЁАввЁБжиИДВтСПШ§ДЮЃЌЫљЕУЪ§жЕЗжБ№13.6ЃЌ13.5ЃЌ13.4ЁЃКіТдЛьКЯЧАКѓШмвКЬхЛ§ЕФЮЂаЁБфЛЏЃЌетЖЮЪБМфФкЦНОљЗДгІЫйТЪv(KMnO4)ЃН___________ ЁЃ
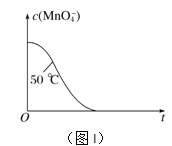
ЂмвбжЊЪЕбщЂй50ЁцЪБc(MnO![]() )ЁЋЗДгІЪБМфtЕФБфЛЏЧњЯпШчЭМIЁЃШєБЃГжЦфЫћЬѕМўВЛБфЃЌЧыдкзјБъЭМжаЃЌЛГіЪЕбщЂк25ЁцЪБc(MnO
)ЁЋЗДгІЪБМфtЕФБфЛЏЧњЯпШчЭМIЁЃШєБЃГжЦфЫћЬѕМўВЛБфЃЌЧыдкзјБъЭМжаЃЌЛГіЪЕбщЂк25ЁцЪБc(MnO![]() )ЁЋtЕФБфЛЏЧњЯпЪОвтЭМЁЃ______________
)ЁЋtЕФБфЛЏЧњЯпЪОвтЭМЁЃ______________
 ЁЁЁЁ
ЁЁЁЁ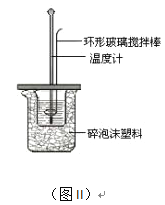
ЃЈ2ЃЉВтЖЈжаКЭШШЕФЪЕбщзАжУШчЭМIIЫљЪОЁЃ
ЂйаДГіЯЁСђЫсКЭЯЁЧтбѕЛЏФЦШмвКЗДгІБэЪОжаКЭШШЕФШШЛЏбЇЗНГЬЪН_______________________ЃЈжаКЭШШЪ§жЕЮЊ57.3 kJ/molЃЉЃК
ЂкШЁ60mL0.50mol/L NaOHШмвККЭ50mL0.50mol/LСђЫсШмвКНјааЪЕбщЃЌЪЕбщЪ§ОнШчЯТБэЁЃ
ЪЕбщДЮЪ§ | Ц№ЪМЮТЖШt1/Ёц | жежЙЮТЖШ t2/Ёц | ЮТЖШВю ЃЈt2-t1ЃЉ/Ёц | ||
H2SO4 | NaOH | ЦНОљжЕ | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
НќЫЦШЯЮЊ0.50 mol/L NaOHШмвККЭ0.50 mol/LСђЫсШмвКЕФУмЖШЖМЪЧ1 g/cm3ЃЌжаКЭКѓЩњГЩШмвКЕФБШШШШнc=4.18 J/(gЁЄЁц)ЁЃдђжаКЭШШЁїH=________________________kJ/molЃЈСаГіМЦЫуЪНЃЉЁЃ
ЂлФмв§Ц№жаКЭШШЦЋИпЕФдвђЪЧЃЈЬюзжФИЃЉ__________ЁЃ
AЃЎЪЕбщзАжУБЃЮТЁЂИєШШаЇЙћВю
BЃЎСПШЁNaOHШмвКЕФЬхЛ§ЪБбіЪгЖСЪ§
CЃЎгУ50mL0.50mol/LДзЫсДњЬцСЫСђЫсНјааЗДгІЃЌ
DЃЎгУЮТЖШМЦВтЖЈNaOHШмвКЦ№ЪМЮТЖШКѓжБНгВтЖЈH2SO4ШмвКЕФЮТЖШ
E. СПШЁСђЫсШмвКЕФЬхЛ§ЪБбіЪгЖСЪ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃбѓжВЮяШчКЃДјКЭКЃдхжаКЌгаЗсИЛЕФЕтдЊЫиЃЌЕтдЊЫивдЕтРызгЕФаЮЪНДцдкЁЃЪЕбщЪвРяДгКЃбѓжаЬсШЁЕтЕФСїГЬШчЯТЃК
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ЈDЁњ
ЈDЁњ![]()
ФГЛЏбЇаЫШЄаЁзщНЋЩЯЪіСїГЬЂкЁЂЂлЩшМЦГЩШчЯТЭМЫљЪОВйзїЁЃ

вбжЊЙ§ГЬЂкЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊCl2ЃЋ2KI===2KClЃЋI2
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉаДГіЬсШЁЙ§ГЬЂйЁЂЂлжаЪЕбщВйзїЕФУћГЦЃКЂй____________ЃЌЂл____________ЁЃ
ЃЈ2ЃЉдкзЦЩеЙ§ГЬжаЃЌЪЙгУЕНЕФЪЕбщвЧЦїгаОЦОЋЕЦЁЂ____________ЁЂ____________(Г§ФрШ§НЧЭт)ЁЃ
ЃЈ3ЃЉFжаЯТВувКЬхЕФбеЩЋЮЊ________ЩЋЃЌЩЯВувКЬхжаШмжЪЕФжївЊГЩЗжЮЊ____________ЁЃ
ЃЈ4ЃЉДгFжаЕУЕНЙЬЬЌЕтЛЙашНјааЕФВйзїЪЧ_______________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЙшМАЦфЛЏКЯЮяЕФЫЕЗЈжаВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
A. дкДжЙшЕФЬсШЁжаЗЂЩњЗДгІ2CЃЋSiO2![]() 2COЃЋSiЃЌЙшдЊЫиБЛЛЙд
2COЃЋSiЃЌЙшдЊЫиБЛЛЙд
B. ЬЋбєФмЕчГиПЩВЩгУЙшВФСЯжЦзїЃЌЦфгІгУгаРћгкЛЗБЃЁЂНкФм
C. гУSiO2жЦШЁЙшЫсЃЌгІЯШЪЙЖўбѕЛЏЙшгыЧтбѕЛЏФЦШмвКЗДгІЃЌШЛКѓдйЭЈШыCO2
D. гЩNa2CO3ЃЋSiO2![]() CO2ЃЋNa2SiO3ПЩжЊЙшЫсЕФЫсадЧПгкЬМЫс
CO2ЃЋNa2SiO3ПЩжЊЙшЫсЕФЫсадЧПгкЬМЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЌвЛЖЬжмЦкдЊЫиМзЁЂввЁЂБћЁЂЖЁдзгађЪ§вРДЮдіДѓЁЃГЃЮТЯТЃЌКЌМзЕФЛЏКЯЮяrХЈЖШЮЊ0.1molЁЄL-1ЪБШмвКpH=13ЁЃЭЌжмЦкдЊЫиМђЕЅРызгжаЃЌввРызгЕФАыОЖзюаЁЁЃpКЭqЗжБ№ЪЧдЊЫиБћКЭЖЁЕФЕЅжЪЃЌЦфжаpЮЊЧГЛЦЩЋЙЬЬхЁЃЩЯЪіЮяжЪЕФзЊЛЏЙиЯЕШчЭМЫљЪО(ВњЮяЫЎвбТдШЅ)ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
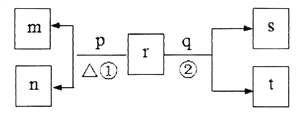
A. дзгАыОЖЕФДѓаЁЙиЯЕЃКМз>вв>Бћ>ЖЁ
B. ЗДгІЂкЕФРызгЗНГЬЪНЮЊЃКC12+H2O![]() H++C1-+HC1O
H++C1-+HC1O
C. mЁЂnЕФвѕРызгдкЫсадЬѕМўЯТВЛФмДѓСПЙВДц
D. МзЁЂввЁЂЖЁЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяСНСНжЎМфОљПЩвдЗЂЩњЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкЗДгІKClO3+6HCl=KCl+3Cl2Ёќ+2H2OЕФЫЕЗЈВЛе§ШЗЕФЪЧ
A. KClO3ЪЧбѕЛЏМС B. KClМШВЛЪЧбѕЛЏВњЮявВВЛЪЧЛЙдВњЮя
C. HClЪЧЛЙдМС D. УПЩњГЩ1molCl2ЯћКФЛЙдМСЕФЮяжЪЕФСПЮЊ2 mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЯђ10mL0.1mol/LNaOHШмвКжаМгШы0.1mol/LЕФвЛдЊЫсHAШмвКЃЌШмвКpHЕФБфЛЏЧњЯпШчЭМЫљЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
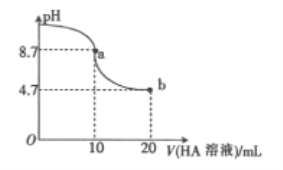
A. aЕуЫљЪОШмвКжа:c(A-)>c(Na+)>c(OH-)>c(H+)
B. aЕуЫљЪОШмвКжа:c(Na+)=0.05mol/L
C. pH=7ЪБЃЌc(Na+)=c(A-)
D. bЕуЫљЪОШмвКжа:c(Na+)<c(A-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЖўдЊЫсЃЈH2AЃЉдкЫЎжаЕФЕчРыЗНГЬЪНЪЧH2A=H++HA-ЃЌHA-![]() H++A2-ЁЃ
H++A2-ЁЃ
ЃЈ1ЃЉNa2AШмвКЯд_________ЃЈЬюЁАЫсадЁБЁАжаадЁБЛђЁАМюадЁБЃЉЁЃРэгЩЪЧ__________ЃЈгУРызгЗНГЬЪНБэЪОЃЉЁЃ
ЃЈ2ЃЉвбжЊ0.1mol/LЕФNaHAШмвКЕФpH=2,дђ0.1mol/LЕФH2AШмвКжаcЃЈH+ ЃЉ_______ЃЈЬюЁА<ЁБЁА>ЁБЛђЁА=ЁБЃЉ0.11mol/LЁЃ
ЃЈ3ЃЉдк0.1mol/LЕФNa2AШмвКжаЃЌЯТСаЮЂСЃХЈЖШЙиЯЕЪНВЛе§ШЗЕФЪЧ__ЃЈЬюзжФИЃЉЁЃ
A.cЃЈA2- ЃЉ+cЃЈHA-ЃЉ=0.1mol/L
B.cЃЈOH-ЃЉ=cЃЈH+ЃЉ +cЃЈHA-ЃЉ
C.cЃЈNa+ЃЉ+cЃЈH+ЃЉ=cЃЈOH-ЃЉ+cЃЈHA-ЃЉ+cЃЈA2-ЃЉ
D.cЃЈNa+ЃЉ=2cЃЈA2-ЃЉ+2cЃЈHA-ЃЉ
ЃЈ4ЃЉШєЯђ0.1mol/LЕФH2AШмвКжаМгШыЕШЬхЛ§ЕШХЈЖШЕФNaOHШмвКЃЌдђШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ__________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкПЩФцЗДгІ2A(g)ЃЋ3B(g) ![]() 4C(g)ЃЋ2D(g)ЃЌдкВЛЭЌЬѕМўЯТЕФЛЏбЇЗДгІЫйТЪШчЯТЃЌЦфжаБэЪОЕФЗДгІЫйТЪзюПьЕФЪЧ
4C(g)ЃЋ2D(g)ЃЌдкВЛЭЌЬѕМўЯТЕФЛЏбЇЗДгІЫйТЪШчЯТЃЌЦфжаБэЪОЕФЗДгІЫйТЪзюПьЕФЪЧ
A. v(A)ЃН0.9 molЁЄLЃ1ЁЄminЃ1 B. v(B)ЃН1.5 molЁЄLЃ1ЁЄminЃ1
C. v(D)ЃН0.8 molЁЄLЃ1ЁЄminЃ1 D. v(C)ЃН0.1 molЁЄLЃ1ЁЄsЃ1
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com