
分析 硫酸氢钠为强电解质,在水溶液中完全电离生成钠离子、氢离子、硫酸根离子;
碳酸氢钠为强电解质,在水溶液中完全电离生成钠离子和碳酸氢根离子,据此分别写出其电离方程式.
解答 解:NaHSO4为强电解质,在水溶液中完全电离生成钠离子、氢离子、硫酸根离子,其离子方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-;
碳酸氢钠为强电解质,完在水溶液中全电离生成钠离子与 碳酸氢根离子,离子方程式:NaHCO3=Na++HCO3-,
故答案为:NaHCO3=Na++HCO3-.
点评 本题考查了电离方程式的书写,题目难度不大,明确电解质的强弱是解题关键,注意弱电解质用可逆号,强电解质用等号,注意掌握电离方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
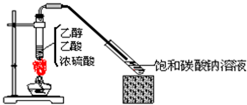 如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是
如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是| A. | 石蕊层仍为紫色,有机层无色 | |
| B. | 石蕊层有两层,上层为紫色,下层为蓝色 | |
| C. | 石蕊层为三层环,由上而下是红、紫、蓝 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AB3 | B. | AB | C. | A3B | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | 只有① | C. | ①和② | D. | 都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体本质特征是具有丁达尔效应 | |
| B. | 摩尔是表示微粒多少的一个基本物理量 | |
| C. | 气体摩尔体积一定是22.4L | |
| D. | BaSO4虽然难溶于水,但BaSO4属于强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1% | |
| C. | amol•L-1H2C2O4溶液与2amol•L-1的NaOH溶液等体积混合后,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) | |
| D. | 0.1mol•L-1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+Na+Cu2+Al3+ |
| 阴离子 | SO42- HCO3-NO3-OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com