
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:不详 题型:单选题
 2Z(g) 达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为( )
2Z(g) 达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为( )| A.1∶3 | B.3∶1 | C.1∶1 | D.1∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( )
nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( )| A.1 | B.2 |
| C.3 | D.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(正反应为放热反应),使用V2O5作催化剂。下列关于催化剂的叙述中,不正确的是( )
2SO3(正反应为放热反应),使用V2O5作催化剂。下列关于催化剂的叙述中,不正确的是( )| A.扩大反应物之间的接触面 |
| B.降低反应所需的能量,增加了单位体积内的活化分子体积分数 |
| C.催化剂在反应过程中质量和化学性质均不改变 |
| D.催化剂在反应过程中不参与化学反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为A. (O2)=0.01 mol·L-1·s-1 (O2)=0.01 mol·L-1·s-1 |
B.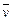 (NO)=0.008 mol·L-1·s-1 (NO)=0.008 mol·L-1·s-1 |
C.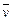 (H2O)=0.003 mol·L-1·s-1 (H2O)=0.003 mol·L-1·s-1 |
D.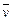 (NH3)=0.002 mol·L-1·s-1 (NH3)=0.002 mol·L-1·s-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
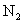 和3 mol
和3 mol 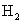 ,在一定条件下反应2min后,则得
,在一定条件下反应2min后,则得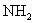 ,总质量为13.6g,如用
,总质量为13.6g,如用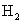 的浓度变化来表示其反应速率,其反应速率为[单位:mol/(L·min)]( )
的浓度变化来表示其反应速率,其反应速率为[单位:mol/(L·min)]( )| A.0.2 | B.0.4 | C.0.6 | D.0.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开始时的反应速率:V(锌粒)>V(锌粉) |
| B.溶液温度升高的快慢:T(锌粒)>T(锌粉) |
| C.最后放出H2的总量:n(锌粒)>n(锌粉) |
| D.达平衡时正逆反应的速率相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,反应M+N=K在温度t2下进行,已知t1>t2,且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者
,反应M+N=K在温度t2下进行,已知t1>t2,且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者 的反应速率
的反应速率| A.前者大 | B.后者大 | C.相等 | D.无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com