
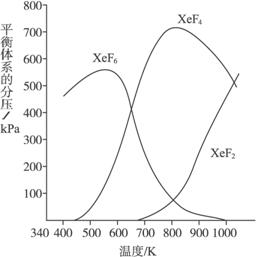
(1)应在_______温度下制备Xe F6,在_______温度下制备XeF4。
(2)Xe和F2生成XeF6和XeF4,生成_______的反应放热更多,理由是__________________。
(3)为有效地制备XeF2,应在______反应条件下为好,理由是______________________。
(1)约550 K 约800 K (2)XeF6 若Xe与F2生成XeF4的反应放热多,反应XeF4+F2![]() XeF6的正反应将是吸热反应,温度升高应有利于XeF6的生成,而由图可知,事实恰恰相反(或答:反应XeF6====XeF4+F2在相对高的温度下发生)
XeF6的正反应将是吸热反应,温度升高应有利于XeF6的生成,而由图可知,事实恰恰相反(或答:反应XeF6====XeF4+F2在相对高的温度下发生)
(3)高温和降低投料中![]() 的比值等 从图中条件可知必须在高温下才能制备XeF2,但高温要求的技术问题太多,因而通过降低投料中
的比值等 从图中条件可知必须在高温下才能制备XeF2,但高温要求的技术问题太多,因而通过降低投料中![]() 的比值,才能有效制备XeF2
的比值,才能有效制备XeF2
解析:问题(1)属“识图”型信息题,问题(2)是勒夏特列原理的活用,升高温度,化学平衡向吸热反应方向移动。问题(3)要求认识到题面交代过的信息,图形是在氟比氙多的条件下(0.125 mol·L-1Xe和1.225 mol·L-1 F2)制作的,可理解为氟、氙比例不同将有不同的图形,需要有更多的创造性思维。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:揭阳市2007年高中毕业班第二次高考模拟考试、化学 题型:022
Xe和F2在一定条件下发生反应,Xe+F2![]() XeF2;XeF2+F2
XeF2;XeF2+F2![]() XeF4;XeF4+F2
XeF4;XeF4+F2![]() XeF6;可得XeF2、XeF4、XeF6三种气态氟化物.当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小.当压强为700 kPa、温度达到1250℃时,测得XeF2的体积分数约为95%.那么,为了有效地制备XeF2,你认为应该采取的合适措施是________.
XeF6;可得XeF2、XeF4、XeF6三种气态氟化物.当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小.当压强为700 kPa、温度达到1250℃时,测得XeF2的体积分数约为95%.那么,为了有效地制备XeF2,你认为应该采取的合适措施是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)Xe和F2反应,可得三种氟化物,视反应条件而定。下图表述的是将0.125mol/L Xe和1.225mol/L F2为始态得到 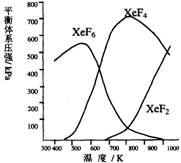 的生成物在平衡体系内的分压与反应温度的关系。
的生成物在平衡体系内的分压与反应温度的关系。
1.应在什么温度下制备XeF6和XeF4?
2.Xe和F2生成XeF6和XeF4,哪个反应放热更多?
生成 的反应放热更多。理由:
3.为有效地制备XeF2,应在什么反应条件下为好?简述理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com