
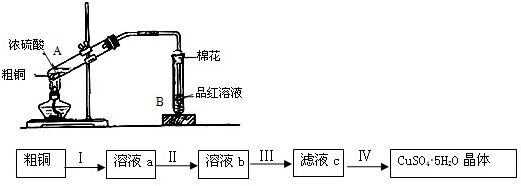
| ||
| ||


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、①② | B、②③ |
| C、①③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
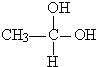 →CH3-CHO+H2O
→CH3-CHO+H2O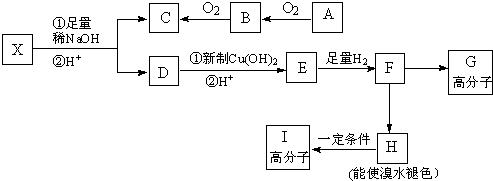
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 编号 | 甲 | 乙 | 丙 | 丁 | 物质转化关系 |
| A | Cu | CuCl2 | CuO | Cu(NO3)2 |  |
| B | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| C | Fe | Fe Cl3 | Fe(OH)3 | Fe2O3 | |
| D | Al2O3 | Al(OH)3 | NaAlO2 | AlCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| -1214.6kJ |
| mol |
| 1 |
| 2 |
| +283kJ |
| mol |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、②③⑦⑧ |
| C、③⑤⑥⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
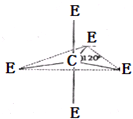 已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,则x+y=46 |
| B、1 mol氯气参加氧化还原反应,一定得到NA 或2NA个电子 |
| C、1升0.1 mol?L-1 NaBr溶液中,HBr和Br-总和为0.1NA个 |
| D、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | ① | ② | ③ | 实验结论 | 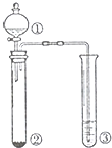 |
| A | 浓硫酸 | Cu | 品红溶液 | SO2具有漂白性 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、 氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸 >硅酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com