
| A.2H2(g)+O2(g)=2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g)=2H2O(1)△H=" +571.6" kJ/mol |
| C.2H2(g)+O2(g)=2H2O(g)△H=" ―571.6" kJ/mol |
D.H2(g)+ O2(g)=H2O(1)△H = ―285.8kJ/mol O2(g)=H2O(1)△H = ―285.8kJ/mol |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:不详 题型:单选题
| A.1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
B.已知C(s)+ O2(g)==CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol O2(g)==CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.1mol H2SO4与lmol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.同温同压下,已知两个放热反应:2A(l)+B(l)="2C(g)" △H1; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
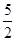 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1
O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1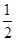 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1
O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1| A.+228.2 kJ·mol-1 | B.-228.2 kJ·mol-1 |
| C.+1301.0 kJ·mol-1 | D.+621.7 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=H2O(l) △H=-285.84kJ·mol-1
O2(g)=H2O(l) △H=-285.84kJ·mol-1 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 |
| B.由“ C(s,石墨)=C(s,金刚石)△H=+1.9kJ·mol-1 ”可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq) + OH-(aq) = H2O(l) △H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g) + O2(g) = 2H2O(l) △H=-285.8kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)
O2(g)  SO3(g) △H =" ―98.32" kJ·mol-1,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H =" ―98.32" kJ·mol-1,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为| A.196.64 kJ | B.196.64 kJ·mol-1 | C.<196.64 kJ | D.>196.64 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H="-24.8" kJ·mol-1
H="-24.8" kJ·mol-1 H="-47.2" kJ·mol-1
H="-47.2" kJ·mol-1 H="+640.5" kJ·mol-1
H="+640.5" kJ·mol-1| A.-218 kJ·mol-1 | B.-109kJ·mol-1 | C.+218 kJ·mol-1 | D.+109 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com