
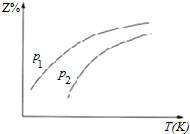
| A. | △H<0 | |
| B. | 若p1>p2,则Y一定呈气态 | |
| C. | 升高温度,该反应的化学平衡常数减小 | |
| D. | 反应处于平衡状态时,有c(X):c(2)=1:2 |
分析 采取定一议二方式解答,当压强一定时,温度越高,平衡向吸热方向移动,而Z的含量越大,说明正反应为吸热反应,
A.压强一定时,温度越高,平衡向吸热方向移动,则Z的含量越大;
B.若p1>p2,当温度一定时,压强越大,Z的含量越大,则平衡向正反应方向移动;
C.该反应是吸热反应,升高温度,平衡向正反应方向移动;
D.平衡时各组分的量与反应的初始物质的量和转化率有关.
解答 解:A.压强一定时,温度越高,平衡向吸热方向移动,则Z的含量越大,说明正反应为吸热反应,△H>0,故A错误;
B.若p1>p2,当温度一定时,压强越大,Z的含量越大,则平衡向正反应方向移动,说明正反应方向是气体体积减小的方向,则Y一定是气体,故B正确;
C.该反应是放热反应,升高温度,平衡向正反应方向移动,则平衡常数减小,故C错误;
D.当n(X):n(Z)=1:2时,该反应可能达到平衡状态也可能没有达到平衡状态,这与反应的初始物质的量和转化率有关,故D错误.
故选:B.
点评 本题考查外界条件对化学反应速率、化学平衡移动影响、学生识图能力,做题时注意分析图象曲线的变化特点,采取定一议二解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | V1=V2=V3 | B. | V1>V3>V2 | C. | V2>V3>V1 | D. | V1>V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
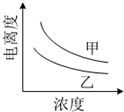 结合如表回答下列问题(均为25℃时的数据)
结合如表回答下列问题(均为25℃时的数据)| 酸 | 电力平衡常数(Ka) | 酸 | 电力平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 | |
| B. | SO2是大气污染物,可以用生石灰除去工业废气中的SO2 | |
| C. | 明矾水解产生Al(OH)3胶体粒子,可除去悬浮物 | |
| D. | 使用清洁能源是防止酸雨发生的重要措施之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的物质的量相同 | B. | H+ 物质的量相同 | ||
| C. | OH-的物质的量浓度不同 | D. | H+的物质的量浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol CO2和CO混合气体含有的碳原子数为NA | |
| B. | 在KIO3+6HI═KI+3I2+3H2O反应中,每生成 3molI2,则转移6NA个电子 | |
| C. | 78gNa2O2与足量的CO2完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol-L-1 Na2S溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
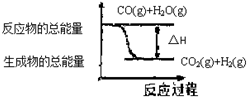
| A. | 依图象可知反应:CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 无法判断反应物总能量与生成物总能量的相对大小 | |
| C. | 表示此反应是吸热反应 | |
| D. | 此反应:△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com