
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4 , 从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
(1)写出下列物质的化学式X、A、B
(2)上述实验流程中加入过量的Na2CO3的目的是 .
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入过量的(填化学式),之后若要获得固体NaNO3需进行的实验操作是(填操作名称)
【答案】
(1)BaCl2[或Ba(NO3)2];BaSO4;AgCl
(2)除去过量的Ba(NO3)2〔或BaCl2〕和AgNO3
(3)Na2CO3;HNO3;蒸发、过滤
【解析】解:(1)如先加入AgNO3 , 则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3 , 使Cl﹣全部转化为AgCl沉淀,则试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4 , 沉淀B为AgCl,所以答案是:BaCl2[或Ba(NO3)2];BaSO4;AgCl;(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3 , 使Cl﹣全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+ , 在所得滤液中加入过量的Na2CO3 , 使溶液中的Ag+、Ba2+完全沉淀,所以答案是:除去过量的Ba(NO3)2〔或BaCl2〕和AgNO3 . (3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3 , 可除去Na2CO3 , 之后蒸发、过滤得到硝酸钠,所以答案是:Na2CO3;HNO3;蒸发、过滤.


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.聚乙烯(PE)和聚氯乙烯(PVC)都是食品级塑料制品的主要成分
B.煎炸食物的花生油和牛油都是可皂化的饱和酯
C.粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
D.大豆富含蛋白质,将其磨成豆浆并煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示。下列有关说法正确的是


A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 如图所示装置可以比较Na2CO3和NaHCO3晶体热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 既能与盐酸反应,又能与NaOH溶液反应的是
①Si;②Al(OH)3;③NaHCO3;④Al2O3;⑤Na2CO3
A.全部 B.①②④ C.②④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验,请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是_______________________________________,此时锥形瓶内溶液的pH为________。
②根据上述数据,可计算出该盐酸的浓度约为____________________(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为__________________,若A原子的最外层电子排布为1s1,则按原子轨道的重叠方式判断,A与C形成的化合物中的共价键类型属于______键。
(2)上述化合物A2C的熔沸点高于化合物DA3的熔沸点,其主要原因可能是____________;
(3)当n=2时,B与C形成的晶体属于 _______晶体,B与C形成的最高价化合物的结构式为_________________ 。
(4)当n=3时,B与C形成的晶体属于_______晶体,其晶体结构如下图所示。该晶体中最小的环由______个微粒构成,一个晶胞中含有______个B微粒,______个C微粒。
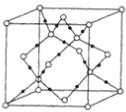
(5)若A原子的最外层电子排布为4s1,B原子的价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为 _______________________ (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2PtCl6 晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂。在此分解反应中,还原产物与氧化产物的物质的量之比是( )
A.2∶3B.1∶3C.4∶3D.3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com