
| A. | 电解质:水溶液是否导电 | |
| B. | 原子晶体:构成晶体的微粒是否是原子 | |
| C. | 共价分子:分子中原子间是否全部是共价键 | |
| D. | 化学平衡状态:平衡体系中各组分的物质的量浓度是否相等 |
分析 A、电解质是在水溶液中或熔融状态下能导电的化合物;
B、由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体;
C、仅由共价键形成的分子是共价分子;
D、平衡体系中各组分的物质的量浓度是否不变的状态是平衡状态.
解答 解:A、电解质是在水溶液中或熔融状态下能导电的化合物,熔融状态下能导电的化合物也是电解质,故A错误;
B、原子晶体微粒是原子,分子间作用力是共价键,故B错误;
C、仅由共价键形成的分子是共价分子,所以分子中原子间是否全部是共价键,故C正确;
D、平衡体系中各组分的物质的量浓度是否不变的状态是平衡状态,故D错误;
故选C.
点评 本题是对教材基本概念的考查,要求学生熟记教材知识,灵活应用.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3>H2O>HF | |
| C. | 密度大小:Rb>K>Na>Li | |
| D. | 等物质的量浓度溶液,酸性强弱顺序:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
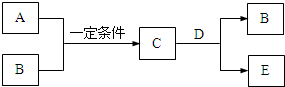 A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图:
A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做焰色反应实验时,应用H2SO4清洗铂丝 | |
| B. | 焰色反应是单质特有的性质 | |
| C. | 碳酸钾在酒精灯上灼烧时能直接观察到紫色火焰 | |
| D. | NaCl与Na2SO4灼烧时火焰颜色均为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
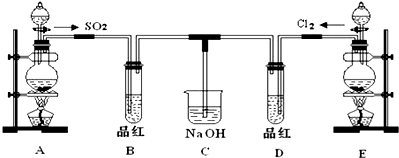
 ;请指出该反应中的液体反应物在反应中所表现出的化学性质:还原性和酸性;若液体中的溶质反应了6mol,则转移的电子的物质的量3mol;
;请指出该反应中的液体反应物在反应中所表现出的化学性质:还原性和酸性;若液体中的溶质反应了6mol,则转移的电子的物质的量3mol;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 晶体中碳原子键全部是碳碳单键 | |
| B. | 石墨烯与金刚石都是碳的同素异形体 | |
| C. | 石墨烯中所有碳原子可以处于同一个平面 | |
| D. | 从石墨中剥离得到石墨烯需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com