
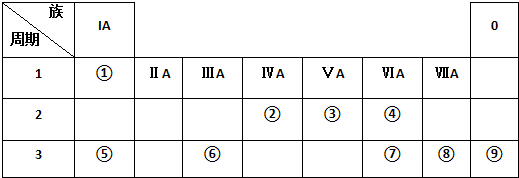
分析 由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)同周期自左而右元素非金属性增强,其氢化物稳定性增强;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸;上述元素中Na的金属性最强,故氢氧化钠碱性最强,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(4)氨气与硝酸反应生成硝酸铵,硝酸铵为离子化合物,据此解答即可.
解答 解:由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+,故答案为:O2-;
(2)同周期自左而右元素非金属性增强,故非金属性Cl>S,非金属性越强,其氢化物稳定性越稳定,故氢化物稳定性:HCl>H2S,故答案为:HCl;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸,化学式为HClO4;上述元素中Na的金属性最强,故氢氧化钠碱性最强,化学式为NaOH,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:HClO4;NaOH;Al(OH)3+OH-=AlO2-+2H2O;
(4)氨气与硝酸反应生成硝酸铵,化学反应方程式为:HNO3+NH3=NH4NO3,硝酸铵中含有N-H共价键、铵根与硝酸根之间的离子键,故答案为:HNO3+NH3=NH4NO3;共价键、离子键.
点评 本题考查元素周期表与元素周期律,比较基础,注意掌握微粒半径比较与金属性、非金属性强弱比较.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 汽油和花生油都可发生皂化反应 | |
| B. | 蚕丝、棉、麻、的主要成分都是纤维素 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 加热马铃薯可使其中的淀粉变成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
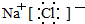 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | IA族元素称为碱金属元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| D. | 地球上元素的分布和它们在元素周期表中的位置有密切关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体的熔点和沸点都很高 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片是负极 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 有6.02×1022个电子经过导线时,锌片质量减少3.25g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
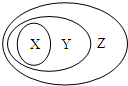 用图表示的一些物质或概念间的从属关系中错误的是( )
用图表示的一些物质或概念间的从属关系中错误的是( )| X | Y | Z | |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 钢铁 | 合金 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com