
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
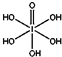 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
分析 (1)卤族元素位于周期表中ⅦA族,属于p区元素;溴处于第四周期ⅦA族;
(2)F元素电负性很大,HF分子之间存在氢键;
(3)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子;
(4)含氧酸中,含非羟基氧原子个数越多,酸性越强(或者同种元素含氧酸中心元素化合价越高,酸性越强);
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子,则Cl原子杂化轨道数目为4;
原子总数相等、价电子总数也相等的微粒互为等电子体;
(6)碘为分子晶体,晶胞中碘分子的排列有2种不同的取向,在顶点和面心不同,层内以4配位数交替配位形成层结构,分子内I原子之间形成非极性键,而分子之间为范德华力,根据均摊法计算晶胞中I原子数目;
(7)根据均摊法可知晶胞中红色球数目为4、黄色球数目为8,结合化学式可知黄色球为Ca2+、黄色球为F-,假设CaF2的相对分子质量为M,表示出晶胞质量,两个离得最近的钙离子是位于顶点和面心上的,则晶胞面对角线长度为2a c,故晶胞棱长为2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}a$ cm,再结合m=ρV计算.
解答 解:(1)卤族元素位于周期表中ⅦA族,属于p区元素;溴处于第四周期ⅦA族,价电子排布式为4s24p5,
故答案为:p;4s24p5;
(2)F元素电负性很大,HF分子之间存在氢键,时氢氟酸以二分子缔合(HF)2形式存在,
故答案为:氢键;
(3)碘的第一电离能越小,碘更容易形成较稳定的单核阳离子,
故答案为:碘;
(4)H5IO6(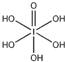 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,
故答案为:<;
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子,则Cl原子杂化轨道数目为4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,与CN-互为等电子体的为N2或 CO等,
故答案为:sp3;N2或 CO;
(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,层内2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中碘分子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即有8个碘原子,故B错误;
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.分子内I原子之间形成非极性键,而分子之间为范德华力,故D正确;
故答案为:AD;
(7)根据均摊法可知晶胞中红色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、黄色球数目为8,结合化学式可知黄色球为Ca2+、黄色球为F-,假设CaF2的相对分子质量为M,则晶胞质量为4×$\frac{M}{{N}_{A}}$g,两个离得最近的钙离子是位于顶点和面心上的,则晶胞面对角线长度为2a c,故晶胞棱长为2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}a$ cm,则4×$\frac{M}{{N}_{A}}$g=ρg/cm3($\sqrt{2}a$ cm)3,解得M=$\frac{\sqrt{2}}{2}$ρNAa3,
故答案为:$\frac{\sqrt{2}}{2}$ρNAa3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、氢键、电离能、分子结构与性质、杂化方式、等电子体、晶胞结构与计算等知识点,需要学生具备扎实的基础与灵活运用能力,需要学生具备一定的空间想象与数学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 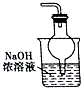 用如图装置除去乙酸乙酯中混有的少量乙酸 | |
| B. | 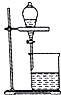 用如图装置可直接分离溴苯和溴 | |
| C. | 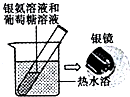 用如图装置验证葡萄糖分子有还原性 | |
| D. | 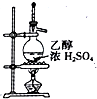 用如图装置制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 屠呦呦获得了2015年诺贝尔奖,她用乙醚提取青蒿素的过程属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 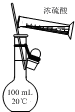 用如图装置配制100 mL 0.1 mol/L的硫酸 | |
| B. |  用如图装置提取碘水中碘 | |
| C. |  用如图装置制取少量乙烯气体 | |
| D. | 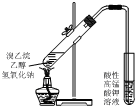 用如图装置验证溴乙烷发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L 的NaCl溶液 | B. | 75mL 2mol/L的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L的KCl溶液 | D. | 75mL 1.5mol/L的CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
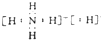 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序:Z、W、Y | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
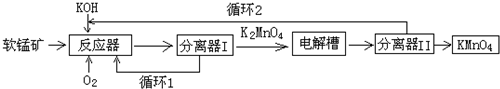
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管的液面 | |
| D. | 称量氯化钠固体,氯化钠放在称量纸上,置于托盘天平的左盘,砝码放在天平的右盘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com