
分析 (1)Cu元素化合价由+2价变为0价、N元素化合价由-3价变为0价,根据得失电子守恒配平;
(2)元素化合价降低,被还原,为氧化剂,元素化合价升高的反应物被氧化,发生氧化反应;
(3)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2中,Fe元素的化合价由+3价降低为0,C元素的化合价由+2价升高为+4价,以此来解答.
解答 解:(1)CuO+NH3-Cu+N2+H2O反应中Cu元素化合价由+2价变为0价、N元素化合价由-3价变为0价,最小公倍数为6,所以CuO、Cu前系数为3,NH3系数为2,再根据原子守恒,化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:3;2;3;1;3;
(2)Cu元素化合价由+2价变为0价化合价降低,被还原,CuO为氧化剂,N元素化合价由-3价变为0价,NH3被氧化,发生氧化反应,
故答案为:CuO;NH3;
(3)该反应中,Fe元素的化合价由+3价降低为0,Fe元素被还原,Fe2O3为氧化剂,得到6e-,C元素的化合价由+2价升高为+4价,则CO为还原剂,失去6e-,则电子转移的方向和数目为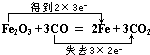 ,
,
故答案为: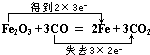 .
.
点评 本题考查氧化还原反应,为高考高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识相关概念、判断物质具有的性质,难度不大.


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂水解可生成高级脂肪酸和丙三醇 | |
| B. | 淀粉水解的最终产物能与新制的Cu(OH)2悬浊液反应 | |
| C. | 淀粉和纤维素的分子式均可用(C6H10O5)n表示,他们互为同分异构体 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用如图装置,能完成很多电化学实验.下列有关此装置的叙述中,错误的是
利用如图装置,能完成很多电化学实验.下列有关此装置的叙述中,错误的是| A. | 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 | |
| B. | 若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流的阴极保护法 | |
| C. | 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铁电极上的电极反应式为Cu2++2e-═Cu | |
| D. | 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,溶液中各离子浓度都不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 磷元素位于元素周期表的第三周期第ⅤA族 | |
| B. | 磷元素是非金属元素 | |
| C. | 磷原子比氮原子和硫原子的得电子能力强 | |
| D. | 磷的最高价氧化物的水化物可以写成H3PO4或HPO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子,锌是负极 | |
| B. | 电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
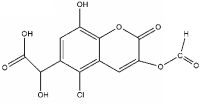
| A. | 能发生加成、取代、氧化反应 | |
| B. | 1 mol该物质最多可与7mol NaOH反应 | |
| C. | 1 mol该物质最多可与6 mol H2反应 | |
| D. | 能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化与液化 | B. | 液体燃料呈雾状喷出 | ||
| C. | 通入大量的空气 | D. | 将煤块粉碎 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com