
分析 (1)已知:①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1?
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1?
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1?
根据盖斯定律,①+③-②可得:C(s)+2H2(g)═CH4(g),焓变也进行相应计算;
(2)已知:②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1?
④H2O(l)═H2O(g)△H=+44.0kJ•mol-1?
根据盖斯定律,②+④×2可得:CH4(g)+2O2(g)═CO2(g)+2H2O(g).
解答 解:(1)已知:①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1?
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1?
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1?
根据盖斯定律,①+③-②可得:C(s)+2H2(g)═CH4(g),则△H=-571.6kJ•mol-1-393.5kJ•mol-1-(-890.3J•mol-1)=-74.8 kJ•mol-1,
故答案为:-74.8 kJ•mol-1;
(2)已知:②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1?
④H2O(l)═H2O(g)△H=+44.0kJ•mol-1?
根据盖斯定律,②+④×2可得:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ•mol-1.
点评 本题考查运用盖斯定律进行反应热计算、热化学方程式的书写,关键是根据已知热化学方程式构造目标化学方程式,有利于基础知识的巩固.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) | |
| D. | 反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碳原子数(n) | 6 | 8 | 10 | 12 | … |
| 结构简式 | 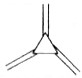 | 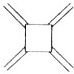 | 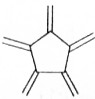 | 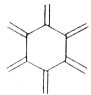 | … |
| A. | 轴烯的通式可表示为CnHn | |
| B. | n=100的轴烯分子中含有50个碳碳双键 | |
| C. | n=6的轴烯分子的同分异构体中含有两个碳碳三键的结构有6种 | |
| D. | n=8的轴烯分子的同分异构体可能属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
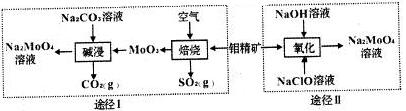
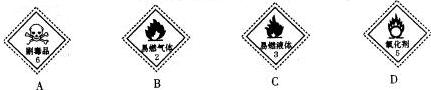
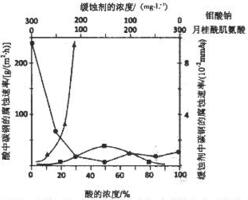
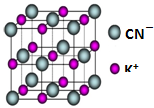
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的一氯代物只有一种 | B. | 苯的邻位二氯代物只有一种 | ||
| C. | 苯的间位二氯代物只有一种 | D. | 苯的对位二氯代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 . H2O2
. H2O2 NH4Cl
NH4Cl
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com