
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是

A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】某包黑色固体混合物可能含有铁粉、氧化铜、炭粉中的二种或三种,取 86.4g 此固体混合物通足量氢气并加热使之反应完全,剩余固体质量 73.6g ,将此剩余固体溶于 1000mL0.500mol·L-1 硫酸中,过滤,向滤液中加入 500mL 某浓度 NaOH 溶液,恰好使沉淀完全,将沉淀灼烧得固体 32.0g。试计算:
(1)所用 NaOH 溶液的浓度是____________mol·L-1。
(2)固体混合物的成分及其物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列互为同位素的是__________;互为同素异形体的是__________;(填序号)
①H2O与H2O2;②金刚石与石墨;③汞与水银;④16O和18O
(2)请写出以下物质或微粒的电子式:H2O__________NaCl__________。
(3)下面是同学们熟悉的物质:O2、HCl、Na2O、NH4Cl、NaOH。这些物质中,只含有离子键的是_________;(填化学式,下同)属于共价化合物的是______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,正确的是
A. 区分晶体和非晶体最可靠的科学方法是对固体进行 X射线衍射
B. 离子键、金属键无方向性和饱和性,而所有共价键都有方向性和饱和性
C. 处于能量最低状态时,外围电子排布为4d15s2的某元素原子,M能层共有8个电子,该元素位于![]() 区第ⅢB族
区第ⅢB族
D. 对充有氖气的霓虹灯管通电,灯管发出红色光.产生这一现象的主要原因是电子由基态向激发态跃迁时以光的形式释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
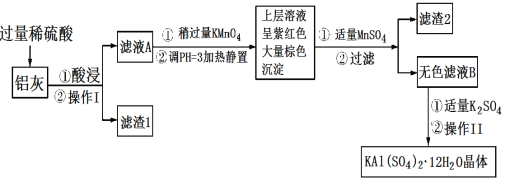
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
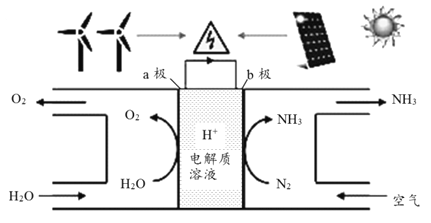
下列说法正确的是
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-== 2NH3
D. a极上每产生22.4L O2流过电极的电子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com