
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ①③② |
分析 溶液含有Ba2+、Ag+、Cu2+,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,以此解答该题.
解答 解:Ag+、Cu2+均与NaOH反应生成沉淀,Ba2+、Ag+均与K2SO4溶液反应生成沉淀,则这三种离子逐一沉淀并加以分离,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,即顺序为③②①,
故选B.
点评 本题考查常见离子的检验及分离,为高频考点,把握离子之间反应为解答的关键,侧重分析与应用能力的考查,注意逐一沉淀的条件限制,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
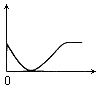
| A. | 稀盐酸中加一定量CaCO3(横坐标是碳酸钙的质量,纵坐标为气体体积) | |
| B. | Ca(OH)2溶液中滴入溶液(横坐标是Na2CO3溶液的体积,纵坐标为沉淀质量) | |
| C. | 稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力) | |
| D. | 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12倍 | B. | 24倍 | C. | 48倍 | D. | 96倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量盐酸 | B. | 适量NaOH | C. | 适量NaHCO3 | D. | 适量KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol NaOH的质量是40 g/mol | |
| C. | 1gH2和lgN2含分子数相等 | |
| D. | 等质量的N2、CH4、CO、H2O中,CH4含分子数最多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com