
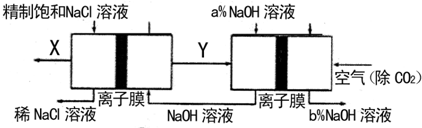
�ȼҵ�Ǹߺ��ܲ�ҵ��Ϊ�����ԭ�ϵ������ʣ�������Y������Ϊȼ�ϵ��ȼ�ϣ�Ϊ���ع��磻X������Ϊ�ѵ�ұ��ԭ�ϣ������ֹ�������У�������ϵĴ�����ת����ϵ����ͼ��ʾ�������ȼҵװ���еĵ缫δ��������õ����ӽ���Ĥֻ����������ͨ����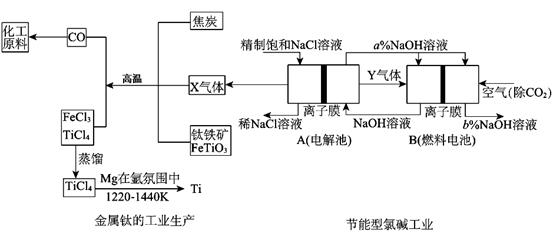
(1)����ͼ�еĽ������ȼҵ���֣�X��Y�ֱ��� �� (�ѧʽ)�������Ƚ�ͼʾ��NaOH��������a����b���Ĵ�С ��
��д��ȼ�ϵ��B�������Ϸ����ĵ缫��Ӧ�� ��
(2)д���������Ȼ����õ����Ȼ��ѵĻ�ѧ����ʽ ��
(3) TiCl4��¶�ڳ�ʪ������ð���̣�������ҪΪ��ɫ�Ķ������ѵ�ˮ����H2TiO3��д���÷�Ӧ�Ļ�ѧ����ʽ ��
(4)��֪����Mg(s)+Cl2(g)=MgCl2(s) ����=��641kJ��mol��1��
��1/2Ti(s)+ Cl2(g) =1/2TiCl4(1) ��������=��385 kJ��mol��1��
��2Mg(s)��TiCl4(1)��2MgCl2(s)��Ti(s)�ķ�Ӧ��Ϊ
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
| �� |
| ||
| �� |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| M(Cl2) |
| 2M(NaOH) |
| 71 |
| 80 |
| M(Cl2) |
| 2M(NaOH) |
| 71 |
| 80 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com