
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几
种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积),回答下列问题: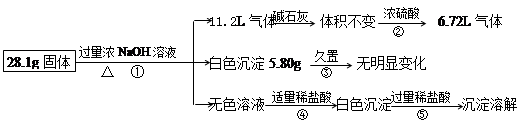
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: 。
(4)请根据计算结果判断混合物中是否含有AlCl3_ _(填“是”或“否”),你的判断依据是 。
⑴否 ⑵是,气体通过浓硫酸减少4.48L。
(3)H++OH-=H2O H2O+AlO2-+H+=Al(OH)3↓
(4)否,由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,而计算出三者质量之和刚好等于28.1g,所以原混合物中一定没有AlCl3。
解析试题分析:根据反应现象和化学计算判断物质的组成,根据加入氢氧化钠溶液得到白色沉淀,可推出无氯化亚铁;生成的气体通过碱石灰体积不变,而通过浓硫酸减少,说明气体中含有氨气,混合物中含有硫酸铵;③加入盐酸,先和①中过量的氢氧化钠反应,然后盐酸再与偏铝酸根反应,生成白色氢氧化铝沉淀;白色沉淀5.80g为氢氧化镁,可算出化合物中氯化镁的质量,气体通过浓硫酸减少4.48L,为氨气的体积,可求出硫酸铵的质量,剩余的6.72L气体为铝与氢氧化钠溶液反应生成的氢气,然后求出Al、(NH4)2SO4和MgCl2三者质量之和28.1g,正好等于原固体总质量,所以原混合物中一定不含AlCl3。
考点:本题考察物质的推断、离子方程式的书写及化学计算。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
某河道两旁有甲、乙两个化工厂。它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
(1)经测定甲厂的废水明显呈酸性,故乙厂废水中所含的三种离子应该是 。
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,过滤所得固体的成分是 ,要进一步分离出银,方法是 。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出生成红褐色沉淀的离子方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: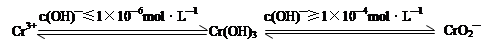
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式 。
②完成用离子方程式表示溶液pH不能超过10(即c(OH)—≥1×10—4mol·L—1)的原因为Cr(OH)3 + OH-= +2H2O。
(2)在硝酸工业生产吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,完成反应方程式:NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2 ,该反应中能用纯碱代替氢氧化钠溶液发生反应的原因是利用了Na2CO3水解呈现的 性。
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,完成有关反应的离子方程式为:
___________+3OH-=Al(OH)3↓+2F-;__________+3OH-=Al(OH)3↓+3F-。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:
①写出反应①的离子方程式 。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
(4)FeO42—在水溶液中的存在形态图如图所示。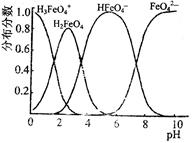
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中, 转化为 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2DZ Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式:_____________________。萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是___________________________。
(2)如图是用双硫腙(HzDz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~ CCl4络合萃取法处理废水。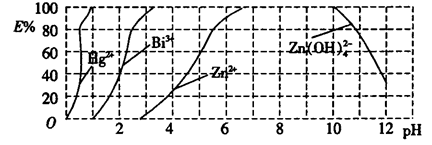
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH=________。
②当调节pH=2时,铋(Bi)的存在形式有_________________。
(3)污水中的亚汞离子(Hg2+ 2)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化(Hg2+ 2),写出该反应的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )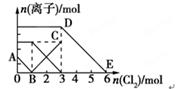
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入2molCl2时,溶液中已发生的离子反应为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2∶1∶3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列过程中没有发生氧化还原反应的是
| A.天然气燃烧提供热量 |
| B.氯水使红色纸张褪色 |
| C.钢铁制品在空气中被腐蚀 |
| D.二氧化硫通人品红溶液中,溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com