
【题目】甲、乙、丙、丁四种易溶于水的物质,分别由NH![]() 、Ba2+、Mg2+、H+、OH-、Cl-、HCO
、Ba2+、Mg2+、H+、OH-、Cl-、HCO![]() 、SO
、SO![]() 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
A.甲溶液含有Ba2+ B.乙溶液含有SO![]()
C.丙溶液含有Cl- D.丁溶液含有Mg2+
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2 240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B. 增大压强可加快SO2转化为SO3的速率
C. 黄绿色的氯水光照后颜色变浅
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )

A.图2装置中Cu电极上发生的电极反应式为:Cu-2e-==Cu2+
B.图1为原电池装置,Cu电极上产生的是O2
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电流均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌焙砂主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物。下图是工业上利用锌焙砂制取金属锌的流程图。
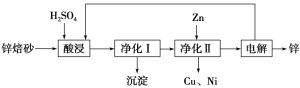
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式: _________________________________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe(OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是__________________________________。
(3)本流程中可以循环利用的物质除硫酸锌外还有__________________。
(4)若没有净化Ⅱ操作,则对锌的制备带来的影响是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示)__________________ ________。
(2)混合溶液中由水电离出的c(OH-)______0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________________mol·L-1,
c(OH-)-c(HA)=________________mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”);同温度下等浓度的下列四种盐溶液,按pH由大到小的顺序排列是__________________(填序号)。
A.NH4HCO3 B.NH4A
C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com