
| A. | H2 | B. | Cl2 | C. | NO | D. | NO2 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个隔离的不同半电池通过盐桥连接可以组成原电池 | |
| B. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| C. | 在铁上镀银,用银作阳极 | |
| D. | 牺牲阳极的阴极保护法利用的是原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
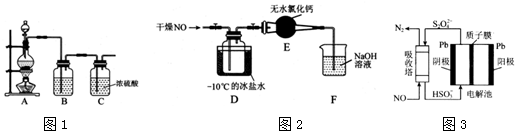
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 纯净的H2在Cl2中燃烧 | 安静地燃烧,并发出苍白色火焰 | 说明燃烧不一定需要氧气参加 |
| B | 分别将蘸有浓氨水和浓硫酸的玻璃棒靠近 | 产生白烟 | NH3能和酸反应生成了相应的铵盐 |
| C | 把SO2通入高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 说明SO2只具有漂白性 |
| D | 高温下,SiO2与纯碱混合加热,产生气体通入澄清石灰水 | 石灰水变浑浊 | 说明硅酸的酸性比碳酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 析氢腐蚀 | B. | 吸氧腐蚀 | C. | 化学腐蚀 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:填空题
物质的化学变化乍看起来,好像十分复杂,难以把握,而实际上是有规律可循的。认识化学原理并将化学原理应用于实际正是化学的魅力所在。
I.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
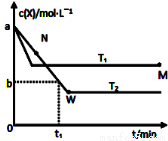
①该反应的化学平衡常数表达式为:_____________
②M点的正反应速率v正_________(填“>”、“=”或“<”)N点的逆反应速率v逆;T2下,在0~t1时间内,v(Y)=_______________;该反应进行到M点放出的热量_________(填“>”、“=”或“<”)进行到W点放出的热量。
③M点时再加入一定量的X,平衡后X的转化率___________(填“增大”、“减小”或“不变”)
II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_________________
III.下图是某种燃料电池原理示意图:
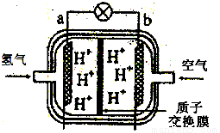
(1)该燃料电池工作过程中,其正极反应式为:________________________。
(2)若用此燃料电池作为电源向铁制品上镀上一层铜,则铁制品要连接在燃料电池的__________极(填“a”或“b”)上.若用此燃料电池电解精炼银,应使粗银作电解池的____________极,使用AgNO3和HNO3的混合溶液作电解液,若阴极有少量红棕色气体生成,则生成该气体的电极反应式为:__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
对于Zn(s)+H2SO4(aq)= ==ZnSO4(aq)+H2(g) ΔH<0的化学反应,下列叙述不正确的是
==ZnSO4(aq)+H2(g) ΔH<0的化学反应,下列叙述不正确的是
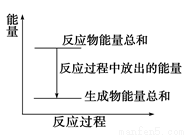
A.反应过程中能量关系可用图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池,锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体为11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com