
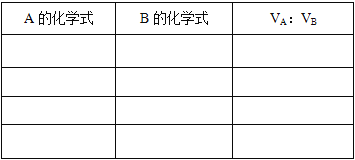
【题目】饱和烃A和不饱和烃B在常温下均为气体,其中A含的碳原子数多于B。将A、B按一定比例混合,1L混合气体完全燃烧后在同温同压下得到3.6LCO2。
(1)试推断该混合气体的可能组成及A、B混合时的体积比,将结果填入表中。_______________________
(2)1mol该混合气体恰好能使含0.2mol溴的四氯化碳溶液完全褪色,则A和B的化学式分别为________和_________。
(3)1mol该混合气体在氧气中完全燃烧,得到68.4g水,则A和B的化学式分别为_________和__________。
(4)120℃时,1LA和1LB与足量O2混合后点燃,在同温同压下体积增大2L,则A和B的化学式分别为_________和_________。
【答案】①C4H10、C3H6、3:2;②C4H10、C2H4、4:1③C4H10、C2H2、4:1④C4H10、C3H4、3:2; A:C4H10 B:C2H2或C3H6; C4H10 C3H4 C4H10 C3H6
【解析】
(1)根据体积之比等于物质的量之比,由混合气体1L充分燃烧后得到同温同压下3.6LCO2,可知混合气体的平均分子式为C3.6Hx,然后根据要想碳原子的平均值为3.6,必须有一种烃的碳原子数小于3.6,另一种烃的碳原子数大于3.6,且碳原子数若>4,那么常温下不是气体,故一种烃中最多为4个碳,据此讨论即可;
(2)如果是炔烃与溴水加成,炔应为0.2mol,如果是烯烃与溴水加成,.即烯烃应为0.4mol;
(3) 68.4g水的物质的量为![]() ,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则
,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则![]() =3.8,解得y=7.6;
=3.8,解得y=7.6;
(4)根据烃的燃烧规律:CxHy+(x+![]() y)O2
y)O2 ![]() CO2+
CO2+![]() yH2O(气),结合气体体积差量法计算平均氢原子数,得到气体的组成即可。
yH2O(气),结合气体体积差量法计算平均氢原子数,得到气体的组成即可。
(1)因1升混合气体充分燃烧后生成3.6升CO2,且A分子的碳原子数比B分子的多,混合气体只能由碳原子数大于3.6的烷烃(C4H10)和碳原子数小于3.6的烯烃或炔烃(C3H6和C2H4、C3H4和C2H2)组成.它们有四种可能的组合:C4H10、C3H6;C4H10、C2H4;C4H10、C3H4;C4H10、C2H2;根据每一种组合中烷烃和烯烃的碳原子数及燃烧后生成的CO2体积,可确定A和B的体积比,如: ,则V(C4H10):V(C2H4)=4:1,C4H10;C3H6=3:2;②C4H10:C2H2=4:1;C4H10:C3H4=3:2,
,则V(C4H10):V(C2H4)=4:1,C4H10;C3H6=3:2;②C4H10:C2H2=4:1;C4H10:C3H4=3:2,
故答案为:①C4H10、C3H6、3:2;②C4H10、C2H4、4:1③C4H10、C2H2、4:1④C4H10、C3H4、3:2;
(2)如果是炔烃与溴水加成,炔应为0.2mol,因此炔烃与溴的物质的量之比为1:2,如果是烯烃与溴水加成,即烯烃应为0.4mol,烯烃与溴水物质的量之比为1:1,故答案为:A:C4H10;B:C2H2;或A:C4H10;B:C3H6;
(3) 68.4g水的物质的量为![]() ,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则
,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则![]() =3.8,解得y=7.6,
=3.8,解得y=7.6,
①若为C4H10、C3H6、3:2,根据则含有氢原子![]() 不符合;
不符合;
②若为C4H10、C2H4、4:1,根据则含有氢原子![]() 不符合;
不符合;
③若为C4H10、C2H2、4:1,根据则含有氢原子![]() 不符合;
不符合;
④若为C4H10、C3H4、3:2,根据则含有氢原子![]() ,符合;
,符合;
故A和B的化学式分别为C4H10和C3H4;
(4)设1L气态烃与氧充分燃烧后体积变化为△VL,则:
CxHy+(x+![]() y)O2
y)O2 ![]() CO2+
CO2+![]() yH2O(气)△V
yH2O(气)△V
1 x+![]() 1
1 ![]()
![]() -1
-1
2L 2L
![]() =
=![]() ,解y=8,平均分子式中H原子为8个,故组合①符合题意,即A:C4H10;B:C3H6。
,解y=8,平均分子式中H原子为8个,故组合①符合题意,即A:C4H10;B:C3H6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,28.80g金属单质A与1.20molCl2完成反应,生成1.20molAClx,则x=__________,若A原子核内质子数等于中子数,则A原子核内中子数为__________ ,氯原子结构示意图为____________。
(2)现有氨气3.4g,在标准状况下其体积为____________,含有氮原子的数目为_____ ;将气体全部溶于水,配成500mL溶液,该溶液的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示,A为常见调味品,B为常见液体,C、E是金属。D、F为气态单质,其中D为黄绿色。J为红褐色固体,A、C、G、I、K的焰色反应均为黄色。K是一种含+6价元素的含氧酸盐,其摩尔质量为166 g·mol-1。

(1)物质B的电子式为___。物质D所含元素在周期表中的位置是___。
(2)写出反应②的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(3)写出反应④的离子方程式:___。
(4)写出反应⑥的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 25℃、101KPa条件下22克CO2所含的原子数目为1.5NA
B. 标准状况下0.1molH2O含有的分子数目为0.1NA
C. 0℃、101KPa条件下03NA氧气的体积是6.72升
D. 58.5克NaCl固体中含有的离子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1Ba(OH)2溶液300 mL(忽略溶液体积变化),反应后溶液中SO42-的物质的量浓度为
A.0.4 mol·L-1B.0.1 mol·L-1C.0.2 mol·L-1D.0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液中溶质的质量分数或溶液中溶质的物质的量浓度,试判断并求解。
(1)已知某氢氧化钠溶液VL中含有n个氢氧根离子,可求出此溶液的___是___。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液的___为___。
Ⅱ.常温下,10.0mL1.0molL-1的H2SO4(aq),加水稀释到500mL,所得H2SO4溶液的浓度为___molL-1;蒸发浓缩使溶液的体积为2.40mL,所得H2SO4溶液的浓度为___molL-1。(结果保留小数点后一位)
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为___。(结果保留小数点后一位)
Ⅳ.现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-现取三份各100mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。
。
该混合液中一定含有___,可能含___,且n(K+)___(填取值范围)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
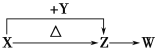
请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
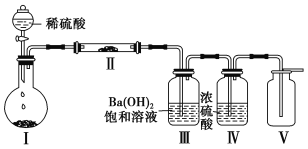
①装置Ⅰ中反应的化学方程式是 ,
装置Ⅱ中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 。
(从上图选择必要装置,填写编号)
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
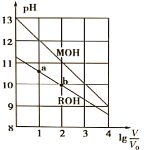
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com