
”¾ĢāÄæ”æ(1)ijĪĀ¶ČĻĀ£¬Ļņ2m g 16%µÄCuSO4ČÜŅŗÖŠ¼ÓČėm g CuSO45H2O£¬ČÜŅŗĒ”ŗĆ“ļµ½±„ŗĶ£¬øƱ„ŗĶČÜŅŗÖŠCuSO4µÄÖŹĮæ·ÖŹżĪŖ_____”£
(2)±ź×¼×“æöĻĀ£¬1Ģå»żĖ®æÉČܽāVĢå»żHClĘųĢ壬ĖłµĆČÜŅŗµÄĆܶČĪŖ¦Ńg/cm3£¬ŌņĖłµĆČÜŅŗČÜÖŹµÄÖŹĮæ·ÖŹż±ķŹ¾ĪŖ_____£¬ČÜÖŹµÄĪļÖŹµÄĮæÅØ¶Č±ķŹ¾ĪŖ_____”£
(3)ČōŅŌ¦Ų1ŗĶ¦Ų2·Ö±š±ķŹ¾ÅضČĪŖa molL©1ŗĶb molL©1ĮņĖįČÜŅŗµÄČÜÖŹµÄÖŹĮæ·ÖŹż£¬ĒŅÖŖ 2a£½b£¬ŌņĻĀĮŠĶʶĻÕżČ·µÄŹĒ(ĮņĖįČÜŅŗµÄĆܶȱȓæĖ®µÄ“ó)_____(ĢīŠņŗÅ)
A. 2¦Ų1£½¦Ų2 B. ¦Ų2£¼2¦Ų1 C. ¦Ų2£¾2¦Ų1 D. ¦Ų1£¼¦Ų2£¼2¦Ų1
(4)ČōŅŌ¦Ų1ŗĶ¦Ų2·Ö±š±ķŹ¾ÅضČĪŖa molL©1ŗĶb molL©1°±Ė®µÄČÜÖŹµÄÖŹĮæ·ÖŹż£¬ĒŅÖŖ2¦Ų1£½¦Ų2£¬ŌņĻĀĮŠĶʶĻÕżČ·µÄŹĒ(°±Ė®µÄĆܶȱȓæĖ®µÄŠ”)_____(ĢīŠņŗÅ)
A. 2a£½b B. 2a£¼b C. 2a£¾b D. a£¼b£¼2a£®
”¾“š°ø”æ32% ![]()
![]() BD CD
BD CD
”¾½āĪö”æ
(1)ÖŹĮæ·ÖŹż=![]() £»
£»
(2) ÖŹĮæ·ÖŹż=![]() £¬ĪļÖŹµÄĮæÅضČc=
£¬ĪļÖŹµÄĮæÅضČc=![]() £»
£»
(3)ĮņĖįµÄÅضČŌ½“óĆܶČŌ½“ó£¬øł¾Ż![]() ÅŠ¶Ļ¦Ų2”¢¦Ų1µÄ¹ŲĻµ£»
ÅŠ¶Ļ¦Ų2”¢¦Ų1µÄ¹ŲĻµ£»
(4)°±Ė®µÄÅضČŌ½“óĆܶČŌ½Š”£¬øł¾Ż![]() ÅŠ¶Ļa”¢bµÄ¹ŲĻµ”£
ÅŠ¶Ļa”¢bµÄ¹ŲĻµ”£
(1) m(CuSO4)= 2m”Į16%£«m ”Į![]() =0.96m g£¬CuSO4ČÜŅŗµÄÖŹĮæŹĒ2m+m=3m g £¬ÖŹĮæ·ÖŹż=
=0.96m g£¬CuSO4ČÜŅŗµÄÖŹĮæŹĒ2m+m=3m g £¬ÖŹĮæ·ÖŹż=![]() =
=![]() 32%£»
32%£»
(2)¼ŁÉč1Ģå»żĪŖ1L£¬±ź×¼×“æöĻĀ£¬ VĢå»żHClĘųĢåµÄĪļÖŹµÄĮæŹĒ![]() mol£¬ÖŹĮæĪŖ
mol£¬ÖŹĮæĪŖ![]() ”Į36.5g £¬ĖłµĆČÜŅŗÖŹĮæĪŖ
”Į36.5g £¬ĖłµĆČÜŅŗÖŹĮæĪŖ![]() ”Į36.5g+1000g£»ČÜŅŗĢå»żĪŖ
”Į36.5g+1000g£»ČÜŅŗĢå»żĪŖ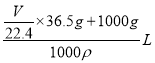 £¬ŌņĖłµĆČÜŅŗČÜÖŹµÄÖŹĮæ·ÖŹż±ķŹ¾ĪŖ(
£¬ŌņĖłµĆČÜŅŗČÜÖŹµÄÖŹĮæ·ÖŹż±ķŹ¾ĪŖ(![]() ”Į36.5g)”Ā(
”Į36.5g)”Ā(![]() ”Į36.5g+1000g) ”Į100%=
”Į36.5g+1000g) ”Į100%=![]() £¬ČÜÖŹµÄĪļÖŹµÄĮæÅØ¶Č±ķŹ¾ĪŖ
£¬ČÜÖŹµÄĪļÖŹµÄĮæÅØ¶Č±ķŹ¾ĪŖ![]() mol”Ā
mol”Ā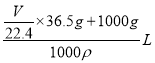 =
=![]() mol/Lӣ
mol/Lӣ
(3)øł¾Ż![]() £¬a=
£¬a=![]() £¬b=
£¬b=![]() £¬2a£½b£¬
£¬2a£½b£¬![]() £¬
£¬ ![]() £¬ĮņĖįµÄÅضČŌ½“óĆܶČŌ½“ó£¬
£¬ĮņĖįµÄÅضČŌ½“óĆܶČŌ½“ó£¬![]() £¬ĖłŅŌ¦Ų2£¼2¦Ų1£»ĪļÖŹµÄĮæÅضČŌ½“ó£¬ÖŹĮæ·ÖŹżŌ½“ó£¬ĖłŅŌ¦Ų1£¼¦Ų2£¼2¦Ų1£¬¹ŹŃ”BD£»
£¬ĖłŅŌ¦Ų2£¼2¦Ų1£»ĪļÖŹµÄĮæÅضČŌ½“ó£¬ÖŹĮæ·ÖŹżŌ½“ó£¬ĖłŅŌ¦Ų1£¼¦Ų2£¼2¦Ų1£¬¹ŹŃ”BD£»
(4)øł¾Ż![]() £¬¦Ų1=
£¬¦Ų1=![]() £¬¦Ų2=
£¬¦Ų2=![]() £¬2¦Ų1£½¦Ų2£¬
£¬2¦Ų1£½¦Ų2£¬![]()
![]() £¬°±Ė®µÄÅضČŌ½“óĆܶČŌ½Š”£¬
£¬°±Ė®µÄÅضČŌ½“óĆܶČŌ½Š”£¬![]() £¬ĖłŅŌ2a>b£¬ÖŹĮæ·ÖŹżŌ½“ó£¬ĪļÖŹµÄĮæÅضČŌ½“ó£¬ĖłŅŌa£¼b£¼2a£¬¹ŹŃ”CD”£
£¬ĖłŅŌ2a>b£¬ÖŹĮæ·ÖŹżŌ½“ó£¬ĪļÖŹµÄĮæÅضČŌ½“ó£¬ĖłŅŌa£¼b£¼2a£¬¹ŹŃ”CD”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖ»ÓŠ»¹ŌŠŌµÄĪŖ£Ø £©
A.ŃĒĮņĖįÄĘ£ØNa2SO3£©B.Ģś·ŪC.HNO3D.ĮņĖįŃĒĢś£ØFeSO4£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃõ»Æ»¹Ō·“Ó¦ŹĒŅ»ĄąÖŲŅŖµÄ·“Ó¦£¬ŌŚ¹¤Å©ŅµÉś²ś”¢ČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾”£
(1)»šŅ©ŹĒÖŠ¹śµÄ”°ĖÄ“ó·¢Ć÷”±Ö®Ņ»£¬ÓĄŌ¶ÖµµĆŃ×»Ę×ÓĖļ½¾°Į”£ŗŚ»šŅ©ŌŚ·¢Éś±¬ÕØŹ±£¬·¢ÉśČēĻĀ·“Ó¦£ŗ2KNO3£«3C£«S=K2S£«N2”ü£«3CO2”ü”£ĘäÖŠ±»Ńõ»ÆµÄŌŖĖŲŹĒ____________£¬»¹Ō²śĪļŹĒ____________”£
(2)ŹµŃéŹŅĪŖ¼ą²āæÕĘųÖŠ¹ÆÕōĘųµÄŗ¬Į棬ĶłĶłŠü¹ŅĶæÓŠCuIµÄĀĖÖ½£¬øł¾ŻĀĖÖ½ŹĒ·ń±äÉ«»ņŃÕÉ«·¢Éś±ä»ÆĖłÓĆČ„µÄŹ±¼äĄ“ÅŠ¶ĻæÕĘųÖŠµÄŗ¬¹ÆĮ棬Ęä·“Ó¦ĪŖ4CuI£«Hg=Cu2HgI4£«2Cu”£
¢ŁÉĻŹö·“Ó¦²śĪļCu2HgI4ÖŠ£¬CuŌŖĖŲĻŌ________¼Ū”£
¢ŚŅŌÉĻ·“Ó¦ÖŠµÄŃõ»Æ¼ĮĪŖ________£¬µ±ÓŠ1 mol CuI²ĪÓė·“Ó¦Ź±£¬×ŖŅʵē×Ó________mol”£
¢Ū±źĆ÷ÉĻŹö·“Ó¦µē×Ó×ŖŅʵķ½ĻņŗĶŹżÄ攣____________________________”£
(3)¹¤ŅµÉĻ³£ÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗ“¦Ąķŗ¬ÓŠCuSŗĶCu2SµÄæóĪļ£¬Ęä·“Ó¦ŌĄķČēĻĀ£ŗ
8MnO4”Ŗ£«5Cu2S£«44H£«=10Cu2£«£«5SO2”ü£«8Mn2£«£«22H2O
6MnO4”Ŗ£«5CuS£«28H£«=5Cu2£«£«5SO2”ü£«6Mn2£«£«14H2O
øł¾ŻÉĻŹö·“Ó¦ŌĄķ£¬Ä³Ń§Ļ°Š”×éÓĆ400 mL 0.075 mol”¤L£1µÄĖįŠŌøßĆĢĖį¼ŲČÜŅŗ“¦Ąķ2 gŗ¬ÓŠCuSŗĶCu2SµÄ»ģŗĻĪļ”£·“Ó¦ŗóÖó·ŠČÜŅŗ£¬øĻ¾”SO2£¬Ź£ÓąµÄKMnO4Ē”ŗĆÓė350 mL 0.1 mol”¤L£1µÄ(NH4)2Fe(SO4)2ČÜŅŗĶźČ«·“Ó¦”£
¢ŁÅäĘ½KMnO4Óė(NH4)2Fe(SO4)2·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ______£¬MnO![]() £«Fe2£«£«H£«=Mn2£«£«Fe3£«£«H2O
£«Fe2£«£«H£«=Mn2£«£«Fe3£«£«H2O
¢ŚKMnO4ČÜŅŗÓė¹ĢĢå»ģŗĻĪļ·“Ó¦ŗó£¬Ź£ÓąKMnO4µÄĪļÖŹµÄĮæĪŖ________ mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠNa2SO4ŗĶFe2(SO4)3µÄ»ģŗĻČÜŅŗ£¬ŅŃÖŖĘäÖŠFe3£«µÄĪļÖŹµÄĮæÅضČĪŖ0.4 mol”¤L£1£¬SO42-µÄĪļÖŹµÄĮæÅضČĪŖ0.7 mol”¤L£1£¬Ōņ“ĖČÜŅŗÖŠNa£«µÄĪļÖŹµÄĮæÅضČĪŖ(””””)
A.0.1 mol”¤L£1B.0.15 mol”¤L£1
C.0.2 mol”¤L£1D.0.25 mol”¤L£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·ÖĄąŹĒѧĻ°ŗĶŃŠ¾æ»ÆѧµÄŅ»ÖÖÖŲŅŖ·½·Ø£¬ĻĀĮŠ·ÖĄąŗĻĄķµÄŹĒ£Ø £©
A.K2CO3ŗĶNa2O¶¼ŹōÓŚŃĪB.H2SO4ŗĶHNO3¶¼ŹōÓŚĖį
C.KOHŗĶNa2CO3¶¼ŹōÓŚ¼īD.Na2OŗĶNa2SiO3¶¼ŹōÓŚŃõ»ÆĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»øöĆܱÕČŻĘ÷ÖŠ£¬ÖŠ¼äÓŠŅ»øöæÉ×ŌÓÉ»¬¶ÆµÄøō°å£¬½«ČŻĘ÷·Ö³ÉĮ½²æ·Ö£¬µ±×ó±ß³äČė1molN2£¬ÓŅ±ß³äČė8gCOŗĶCO2µÄ»ģŗĻĘųĢ壬øō°å“¦ÓŚČēĶ¼ĖłŹ¾Ī»ÖĆ(Į½²ąĪĀ¶ČĻąĶ¬)£¬Ōņ»ģŗĻĘųĢåÖŠCOŗĶCO2µÄ×ÜĪļÖŹµÄĮæĪŖ_____mol£¬ĘäÖŠCOŗĶCO2µÄ·Ö×ÓŹżÖ®±ČĪŖ_____”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆѧŹ½ÓėÖø¶ØĪļÖŹµÄÖ÷ŅŖ³É·Ö¶ŌÓ¦ÕżČ·µÄŹĒ£Ø £©
A.Si”Ŗ¹āµ¼ĻĖĪ¬B.NaHCO3”ŖŠ”ĖÕ“ņ
C.CaCO3”ŖŹģŹÆ»ŅD.KAl(SO4)2”¤12H2O”ŖĀĢ·Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹ŲÓŚĢģČ»ĘųµÄĻĀĮŠŠšŹöÖŠ²»ÕżČ·µÄŹĒ(””””)
A. ĢģČ»ĘųŗĶÕÓĘųµÄÖ÷ŅŖ³É·Ö¶¼ŹĒ¼×Ķé
B. øÄŅŗ»ÆŹÆÓĶĘųĪŖĢģČ»ĘųČ¼ĮĻ£¬Č¼ÉÕŹ±Ó¦¼õÉŁ½ųæÕĘųĮæ»ņŌö“ó½ųĢģČ»ĘųĮæ
C. ĢģČ»ĘųČ¼ĮĻµÄ·ĻĘųÖŠ£¬SO2µČĪŪČ¾ĪļµÄŗ¬ĮæÉŁ
D. ĢģČ»ĘųÓėæÕĘų»ģŗĻµćČ¼£¬²»»į·¢Éś±¬ÕØ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ±ź×¼×“æöĻĀ£¬2.24LCH3OH·Ö×ÓÖŠ¹²¼Ū¼üµÄŹżÄæĪŖ0.5NA
B. 25”ę1LpH=12µÄNa2CO3ČÜŅŗÖŠ£¬ÓÉĖ®µēĄė³öH+µÄŹżÄæĪŖ0.01NA
C. 1molNa2O2Óė×ćĮæCO2³ä·Ö·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ2 NA
D. 0.1molH2ŗĶ0.1molI2ÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ó¦ŗó£¬HI·Ö×Ó×ÜŹżĪŖ0.2NA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com