

分析 (1)已知:①CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1=-49.01kJ/moL
②2CH3OH(g)?CH3OCH3(g)+H2O(l)△H2=-24.52kJ/moL
由盖斯定律可得:①×2+②=④:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l),据此计算;
(2)根据化学平衡状态特征:正逆反应速率相等,各组分含量保持不变分析;
(3)根据化学平衡常数概念列式;
(4)①根据温度对化学平衡的影响分析;
②反应④的二氧化碳的转化率随温度的升高而降低,低温有利;
③反应④在503K时达到平衡,则在该温度下二氧化碳的转化率最高,据此画出图象.
解答 解:(1)已知:①CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1=-49.01kJ/moL
②2CH3OH(g)?CH3OCH3(g)+H2O(l)△H2=-24.52kJ/moL
由盖斯定律可得:①×2+②=④:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l),△H1=-122.541kJ/moL;
故答案为:△H1=-122.541kJ/moL;
(2)反应③CO2(g)+H2(g)?CO(g)+H2O(l),
A、v正(H2)=v逆(H2O),水为纯液态,不能计算反应速率,不能判断化学平衡状态,故A错误,
B、反应参与量满足:n(CO2):n(H2):n(CO):n(H2O)=1:1:1:1,平衡不具有这一特征,故B错误,
C、混合气体的质量减小、恒容,气体体积不变,所以密度发生改变,密度不变时,反应达到化学平衡状态,故C正确,
D、对于该反应,混合气体的质量减小为水的质量,混合气体的平均相对分子质量不变,不能作为判断依据,故D错误,
E、该反应是气体体积缩小的反应,若容器的压强不变,说明正逆反应速率相等,已经达到平衡状态,故E正确;
故答案为:ABD;
(3)反应②2CH3OH(g)?CH3OCH3(g)+H2O(l)△H2=-24.52kJ/moL500K时的化学平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;
故答案为:$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;
(4)①根据图示,反应③的二氧化碳的转化率随温度的升高而增大,说明温度升高后,平衡正向移动,故正反应为吸热反应;
故答案为:△H>0;
②较低温度下,反应反应③二氧化碳的转化率较小而反应④较大,所以较低温度对反应④有利,二甲醚的产率较高;
故答案为:低温;较低温度下,反应反应③二氧化碳的转化率较小而反应④较大,所以较低温度对反应④有利,二甲醚的产率较高;
③反应④在503K时达到平衡,则从298K开始,二氧化碳的转化率逐渐增大,当温度达到503K时,二氧化碳的转化率达到最大,当温度大于503K后,二氧化碳的转化率会减小,则CO2转化率随温度升高的变化曲线为: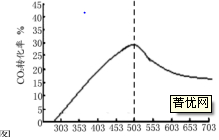 ;
;
故答案为: .
.
点评 本题考查较为综合,涉及盖斯定律的应用、化学平衡状态的判断、化学图象的分析等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握盖斯定律的内容及其应用方法.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
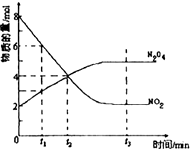 一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、NO3-、Cl- | B. | Mg2+、NH4+、SO42-、NO3- | ||
| C. | H+、K+、Cl-、CH3COO- | D. | K+、Mg2+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com