
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
分析 短周期元素,A、D的最低化合价-2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,D为O元素;C、H都有最高正价+4、最低负价-4,处于ⅣA族,C的氢化物的沸点较高,则C为Si、H为C元素;B、E都有最高正价+5、最低负价-3,处于ⅤA族,B的氢化物的沸点较高,则B为N元素、E为P元素;F、G都有最低化合价-1,处于ⅦA族,G有最高正化合价+7,则F为F元素、G为Cl元素,以此来解答.
解答 解:短周期元素,A、D的最低化合价-2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,D为O元素;C、H都有最高正价+4、最低负价-4,处于ⅣA族,C的氢化物的沸点较高,则C为Si、H为C元素;B、E都有最高正价+5、最低负价-3,处于ⅤA族,B的氢化物的沸点较高,则B为N元素、E为P元素;F、G都有最低化合价-1,处于ⅦA族,G有最高正化合价+7,则F为F元素、G为Cl元素,
(1)表中属于第三周期元素的是S、Si、P、Cl,即A、C、E、G,位于第二周期的为H、D、B、F,
故答案为:H、D、B、F;
(2)G的最高价氧化物的水化物的化学式为HClO4,故答案为:HClO4;
(3)电子层越多半径越大,电子层数相同时,原子序数越大半径越小,则离子半径:r(S2-)>r(F-)>r(O2-);
故答案为:S2-;F-;O2-;
(4)AD2与 BD2混合即发生反应,该反应的化学方程式为SO2+NO2=SO3+NO,故答案为:SO2+NO2=SO3+NO;
(5)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl;
(6)工业生产强酸乙时可用纯碱溶液处理尾气,由NO+NO2+Na2CO3═2X+CO2,由电子及原子守恒可知,X的化学式应为NaNO2,故答案为:NaNO2.
点评 本题考查原子结构及元素周期律,为高频考点,把握元素的化合价、原子半径推断元素为解答的关键,注意化学方程式等常用化学用语、元素周期律等应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
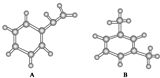
| A. | 两者都能使酸性KMnO4溶液褪色 | B. | 两者都能与溴水反应而使溴水褪色 | ||
| C. | 两者分子中所有原子均可能共平面 | D. | 两者的一氯代物的数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Cu2+、Fe3+、Al3+、K+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )
)是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )| A. | 化学式为C5H9NO4Na | |
| B. | 味精难溶于水 | |
| C. | 只能和盐酸反应,不能和氢氧化钠溶液反应 | |
| D. | 炒菜时味精不宜早放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Ba2+ | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| C. | 放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 该原电池,Zn作正极,可用石墨等作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com